Christian C. Emig
BrachNet, 20, Rue Chaix, F-13007 Marseille (France)
Citation
Emig C.C. (2018).- Brachiopodes récoltés lors de campagnes (1976-2014) dans l’étage Bathyal des côtes françaises méditerranéennes. Redéfinition des limites du système phytal dans le domaine marin benthique.- Carnets de Géologie, Madrid, CG2018_B01, 100 p.
Manuscript online since December 10, 2018 - ISBN13 : 978-2-916733-16-6
[Editor and technical editor: Christian C. Emig]
Télécharger le PDF [8 Mo] Télécharger le PDF - HD [27 Mo] |
 |
Abstract
Brachiopods sampled during expeditions (1976-2014) in the Bathyal Zone of the French Mediterranean coasts. Redefinition of the boundaries of the phytal system in the marine benthic domain.- The distribution of brachiopods along the French Mediterranean coast, especially in the Bathyal zone, was studied in detail from 1976 to 2014 being one of the main objectives of the RCP-CNRS No 728, that took place during the years 1983 to 1989. The data obtained during these campaigns constitute the main objective of this e-book, which focuses on five brachiopod species Novocrania anomala, Gryphus vitreus, Terebratulina retusa, Megathiris detruncata, Platidia anomioides and Megerlia truncata that occur in the Upper Bathyal zone. The e-book consists of nine chapters, of which the last two contain the data concerning all the stations studied, the distributional charts of the five species mentioned, included. The presence of these species in the Mediterranean biocoenoses has put in evidence a hiatus in the systematics based mainly in characters of the shell and rarely in phylogenetic analyses. Another important point that is addressed is the discussion of the validity of some species with fossil record, being Terebratula minor (= Gryphus vitreus), as well as of extant ones, i.e., Terebratula seminulum, chosen as examples. Finally, the infestation of G. vitreus shells by the Ostreobium alga led to reconsider the lower limit of the benthic phytal system and its bathymetric variations as far as in the Bathyal.
Keywords: brachiopod; bathyal; Mediterranean; biocoenosis; aphytal; photic.
Résumé
Au cours de la période allant de 1976 à 2014, la distribution des brachiopodes le long des côtes françaises méditerranéennes a été particulièrement bien suivie, notamment dans l'étage Bathyal. De 1983 à 1989, l'étude de ce groupe zoologique s'est inscrite dans le cadre de la RCP-CNRS n° 728 dont les données des campagnes en mer font l'objet du présent livre : les résultats portent sur les cinq espèces présentes dans le Bathyal supérieur, Novocrania anomala, Gryphus vitreus, Terebratulina retusa, Megathiris detruncata, Platidia anomioides et Megerlia truncata. Ils ont été regroupés dans neuf chapitres, dont les deux derniers constituent les cahiers de tous les prélèvements réalisés dans l'ensemble des stations prospectées et leurs cartes de répartition géographique, ainsi que celles des cinq espèces mentionnées. La présence de ces dernières dans les biocœnoses méditerranéennes a mis en évidence un hiatus avec la systématique à cause d'un usage restreint des seuls caractères de la coquille avec absence de méthodes phylogénétiques, pourtant en grand développement. Une autre mise en évidence porte questionnement sur la validité de certains espèces du registres fossiles, Terebratula minor (= Gryphus vitreus), mais aussi actuelles comme Terebratula seminulum, sont pris comme exemples. Enfin, l'infestation de coquille de G. vitreus par l'algue Ostreobium a conduit à discuter de la limite inférieure du système phytal benthique et de ses variations bathymétriques jusque dans le Bathyal.
Mots-clés : brachiopod ; bathyal ; méditerranée ; biocœnose ; aphytal ; photique.
Avant-Propos
Le but premier de cet ouvrage est de rendre accessible l’ensemble des cahiers de stations de mes campagnes dans l’étage Bathyal au large des côtes de Provence et de Corse (France), en y ajoutant les données de quelques campagnes faites par l’Ifremer (Institut Français de Recherche pour l'Exploitation de la Mer). En effet, le matériel récolté, et en premier chef les brachiopodes, ont été déposés dans divers Muséums, dont les principaux dépôts concernent le Muséum National d’Histoire Naturelle de Paris, le « Museo Nacional de Ciencias Naturales » (CSIC, à Madrid) et le « Instytut Paleobiologii PAN, Warzawa » (Institut de Paléobiologie, Académie des Sciences de Pologne, à Varsovie). Toutes les stations de récolte ont été reportées sur des cartes marines françaises, ainsi que la distribution géographique pour chaque espèce dans les différentes zones prospectées.
Les recherches ont été menées dans le cadre de la Recherche Coopérative sur Programme (Centre National de la Recherche Scientifique) RCP-CNRS n°728 intitulée Etudes des populations actuelles de brachiopodes; transposition aux formes fossiles (1983-1989), dont je fus l'instigateur et le directeur. Le but fut de fédérer les chercheurs français travaillant sur les brachiopodes actuells et fossiles, et d'y adjoindre ceux de nos autres collègues européens qui le souhaitaient. Cette RCP a réuni des chercheurs de Marseille, Lyon, Dijon, Besançon, Paris, Brest, Pau pour la France, de Catane pour l'Italie, d'Oviedo pour l'Espagne et de Glasgow pour la Grande-Bretagne.
Cet ouvrage est aussi l’occasion de résumer brièvement nos connaissances sur l’histoire de la mer Méditerranée, ainsi que les principaux résultats sur l’écologie des espèces de brachiopodes récoltées dans l’étage Bathyal, en rappelant que l’écologie ne peut être éludée des diagnoses de ces espèces, comme en général pour toutes les espèces actuelles, ainsi que fossiles à condition de pouvoir définir le milieu naturel et non les conditions ayant, en fait, entraînées leur fossilisation. Un cas actuel est évoqué suite à un envasement du plateau continental et du Bathyal supérieur en Corse.
Enfin, des données inédites concernant la distribution des coquilles de Gryphus infestée par l’algue verte unicellulaire Ostreobium a conduit à préciser la limite entre les systèmes phytal (ou photique) et aphytal (ou aphotique) dans le domaine benthique. Quelques lignes ont aussi été rédigées pour inciter à la révision de la taxinomie des espèces actuelles de brachiopodes, car l'usage d'une « systématique paléontologique » n'est plus adapté à leur identification.
En appendice, il m’est apparu intéressant, voire utile, d’ouvrir le débat sur l’application des méthodes phylogénétiques dans la taxinomie des espèces et genres de brachiopodes actuels. Deux Terebratula, T. minor et T. seminulum, toutes deux décrites par Philippi (1836), sont prises comme exemples.
1. Introduction
Dans l’Océan Mondial, la distribution bathymétrique des brachiopodes est la plus abondante depuis les zones littorales jusque dans l’étage Bathyal supérieur (Emig, 1988, 2016) : pour ces lophophorates suspensivores, elle s’explique par la nécessité de vivre dans des biotopes soumis à un hydrodynamisme, favorisant l’apport nutritionnel en particules alimentaires et en plancton. Le rebord du plateau continental est particulièrement favorable de par les caractéristiques particulières des masses d’eau y circulant, avec une prédominance de brachiopodes, principalement craniiformes et rhynchonelliformes, dans tout l’étage du Bathyal supérieur (Emig, 1997a, 2016).
La répartition actuelle des brachiopodes s’étend dans tous les océans et mers : la distribution latitudinale montre que les linguliformes, principalement littoraux, sont plus abondants dans la zone intertropicale, tandis que les rhynchonelliformes ont une plus large distribution dans les zones tempérées (Emig, 2016).
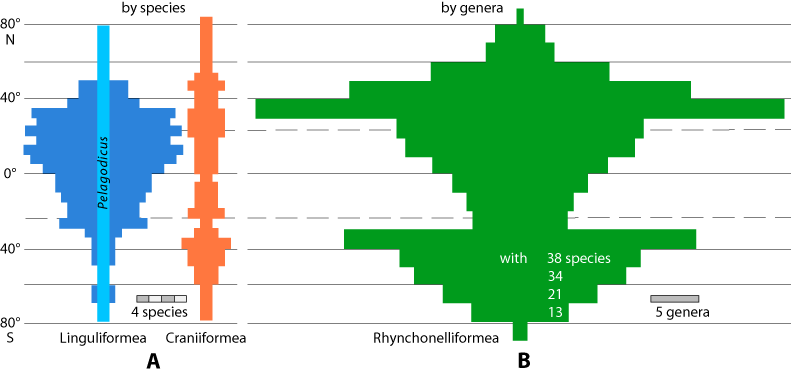
Figure 1-1 : Distribution latitudinale des taxons actuels des trois sous-phylums de brachiopodes : pour les Linguliformea et Craniiformea (A) par espèces ; pour les Rhynchonelliformea (B) par genres. D’après Emig (2016, 2017a).
Notre connaissance de la répartition géographique des brachiopodes le long et au large des côtes françaises est presque exclusivement liée aux résultats de campagnes océanographiques (Álvarez et al., 2016, 2017). En effet, sur le plateau continental, les brachiopodes sont généralement cryptiques, donc peu accessibles depuis la surface, sauf en plongée en scaphandre autonome, d’autant que leur densité est faible et leur taille petite, souvent moins d’un centimètre. En revanche, dans le domaine profond, au-delà du rebord du plateau continental (vers environ 100 m), la diversité des brachiopodes est maximale avec de fortes densités (plusieurs centaines d’individus par m2) dans l’étage Bathyal supérieur (Emig, 1985a, 1988, 1989a, 1997a) (Fig. 1-1, 1-2). Les distributions géographique et bathymétriques des brachiopodes, comme pour toutes les espèces, sont en relation directe avec le biotope et donc avec la biocœnose à laquelle est inféodée une espèce de brachiopode. Ces biocœnoses actuelles et fossiles (thanatocœnoses) ont particulièrement bien été étudiées en mer Méditerranée : aussi la taxinomie des brachiopodes ne peut se faire sans les prendre en compte jusque, comme caractère, dans une analyse cladistique. Cette méconnaissance a récemment conduit à des descriptions sujettes à caution (voir Emig, 2014 ; et Appendices A-C).
En mer Méditerranée, la proximité de la pente continentale, souvent à quelques milles de la côte, a facilité la multiplicité des prélèvements en réduisant fortement le temps de parcours. Les données obtenues dans les stations prospectées au cours des campagnes en mer effectuées entre 1976 et 2014 ont été rassemblées dans les chapitres 8 et 9, avec les cartes de répartition des différentes espèces de brachiopodes. Quelques résultats inédits sont aussi analysés et utilisés pour discuter les limites du système phytal benthique en mer Méditerranée.
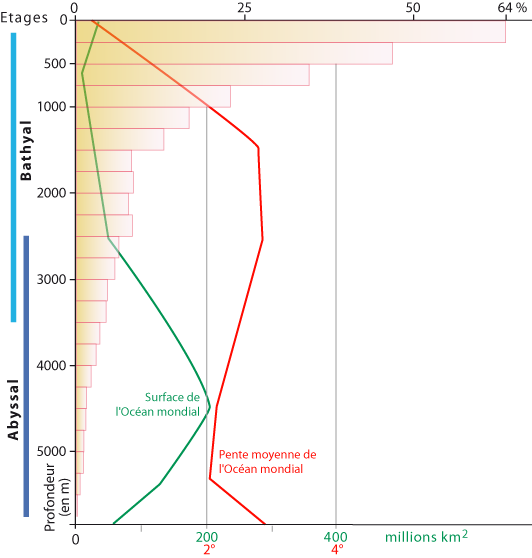
Figure 1-2 : Distribution des brachiopodes actuels en fonction de la profondeur (d’après Emig, 2016). Courbes de la surface et de la pente moyenne de l’Océan Mondial d’après Costello & Chaudhary (2017) : les brachiopodes étant des suspensivores, ils se distribuent principalement dans les zones en pente ou/et à hydrodynamisme depuis le plateau continental jusque dans l’étage Bathyal, selon la topographie locale.
Ce document est principalement technique afin de publier l’ensemble des données récoltées au cours des campagnes en mer et permettre si nécessaire leur utilisation ultérieure ou affiner celles publiées antérieurement par les divers membres de la RCP-CNRS 728 et ceux qui ont bénéficier du matériel récolté. Ce dernier a été déposé dans les collections du Museo Nacional de Ciencias Naturales (CSIC, Madrid), du Muséum National d’Histoire naturelle de Paris et de l’Institut de Paléobiologie (PAN Varsovie).
2. Matériel et techniques utilisés
A. Campagnes et navires.
Les travaux dans le cadre de la Recherche Coopérative sur Programme (Centre National de la Recherche Scientifique) RCP-CNRS n° 728 (Etudes des populations actuelles de brachiopodes; transposition aux formes fossiles, 1983-1989 ; Directeur C. C. Emig), réunissant des spécialistes français, britanniques, espagnols, italiens, ont été basés sur les résultats obtenus durant les campagnes effectuées au large des côtes provençales et autour de la Corse (Tableau 1, Pl. 1). Dans ce même cadre, deux autres campagnes ont eu lieu : l’une en Ecosse (depuis Oban) avec Gordon Curry (Université de Glasgow) et une en Sicile (au large de Syracuse), organisée par Italo Di Geronimo (Université de Catane) (Di Geronimo, 1987) ; elles ne sont pas traitées ici. Le matériel récolté a donné lieu à nombreuses publications sur des sujets et thématiques divers tant en biologie, écologie et paléontologie.
Tableau 1 : Liste des campagnes en mer, dont les résultats sont mentionnés dans le chapitre 8 et les cartes dans le chapitre 9. Abréviations françaises des navires : N/O = navire océanographique ; BISM = bâtiment d’intervention sous la mer ; SMI = sous-marin d’intervention (Pl. 1).
| Campagnes | Dates et Navires | Provence | |
| BraProv 0 | mars 1983 - N/O Antedon | CNRS | Chapitre 8 : Tableau 3 et Tableau 4 |
| BraProv 1 | 28 février - 2 mars 1985 - N/O Antedon | ||
| BraProv 2 | 27 janvier 1986 - BISM Triton & SMI Griffon | Marine Nationale | |
| BraProv 3 | 11 - 14 décembre 1986 - N/O Antedon | CNRS | |
| BraProv 4 | 12 - 16 janvier 1987 - N/O Catherine-Laurence & ROV Modexa | ||
| BraProv 5 | 4 - 6 mars 1987 - N/O Antedon | ||
| BraProv 6 | 30 mars - 3 avril 1987 - N/O Catherine-Laurence | ||
| BraProv 7 | 1 - 5 juin 1987 - N/O Antedon | ||
| BraProv 8 | 22 octobre 1987 - BISM Triton & SMI Griffon | Marine Nationale | |
| BraProv 9 | 16 - 25 novembre 1987 - N/O Korotneff | CNRS | |
| BraProv 10 | 13 octobre 1989 - BISM Triton & SMI Griffon | Marine Nationale | |
| IsoBra | septembre 1996 - N/O Catherine-Laurence | CNRS | Chapitre 8 : Tableau 5 |
| IsoBra | mars 1999 - N/O Catherine-Laurence | ||
| DEPROG | avril 1996 - N/O Europe | IFREMER | Chapitre 8 : Tableau 5 |
| Campagnes | Dates et Navires | Corse | |
| BraCors 1 | 31 mai - 9 juin 1983 - N/O Catherine-Laurence | CNRS | Chapitre 8 : Tableau 6 et Tableau 7 |
| BraCors 2 | 9 - 15 avril 1984 - N/O Catherine-Laurence | ||
| BraCors 3 | 2 - 6 juillet 1984 - N/O Catherine-Laurence | ||
| BraCors 4 | 4 - 8 juillet 1985 - N/O Korotneff | ||
| BraCors 5 | 4 - 22 novembre 1985 - N/O Catherine-Laurence | ||
| BraCors 6 | 19 - 23 janvier 1987 - N/O Catherine-Laurence | ||
| BathyMed | 7 - 22 novembre 1988 - N/O Catherine-Laurence | Chapitre 8 : Tableau 8 et Tableau 9 | |
| Meditis 2 | mai-juin 2012 - N/O Europe | IFREMER | Chapitre 8 : Tableau 10 |
| Meditis 3 | mai-juin 2013 - N/O Europe | ||
| Meditis 4 | mai-juin 2014 - N/O Europe |
Les cahiers des stations sont disponibles dans le chapitre 8 et les cartes de répartition géographique et de distribution bathymétrique figurent dans le chapitre 9. D’autres comptages de Gryphus vitreus ont eu lieu lors de récentes campagnes CNRS et Ifremer (Tableau 1) : ils ont été ajoutés à nos données.
- Les unités de mesure utilisées sont pour la distance, le mille marin [= 1852 m], et pour la vitesse, le nœud [= 1852/3600 m/s ou 1 mille marin/h]. Ces unités, bien qu’en dehors du Système International d’Unités, sont en usage et inclus dans ce dernier. Elles sont utilisées parce qu'un mille marin à la surface de la Terre est correspond par une minute de latitude, ce qui est cohérent avec la latitude et la longitude qui sont mesurées en degrés et minutes et seconde – ou 1/10e de s.
- Les coordonnées géographiques des stations (latitude, longitude) ont été obtenues en utilisant d’abord le système de positionnement Loran-C, remplacé ensuite par celui par satellite de type Global Navigation Satellite Système (dont le GPS) avec une précision au mètre près.
La mise à disposition des cartes bathymétriques précises (à mesures bathymériques rapprochées) par la Mission Océanographique de Méditerranée (Marine Nationale Française, Toulon) a permis de dresser les profils des radiales et a été d’une grande aide dans la préparation des trois plongées en submersible.
B. Engins mis en œuvre
Divers engins ont été utilisés selon les nécessités des recherches et des résultats à obtenir (voir aussi Emig, 1983 ; Anastasios, 2013).
Drague Charcot-Picard
Elle est l’engin principal et indispensable pour récolter des brachiopodes sur la pente continentale.C’est l’engin parfaitement adapté avec la meilleure efficacité. Il existe deux montages selon les besoins :
- une toile de jute, nommé caleçon, doublé d’un filet épais de protection (Fig. 2-1).
- sans caleçon avec un filet de 10 mm de maille, protégé par un filet épais (fil de 10 mm) à grosse maille (Fig. 2-2).
Bien que d’un usage facile, elle exige néanmoins d’une bonne expérience pour un maximum d’efficacité selon les résultats souhaités dans la récolte de brachiopodes, notamment dans des conditions de fonds accidentés comme le sont fréquemment ceux du Bathyal supérieur méditerranéen, surtout sur des pentes relativement fortes et dans les canyons sous-marins. Aussi, les croches [1] sont fréquentes, alors pour limiter les dégâts ou permettre de remonter la drague en cas de croche sérieuse, l’engin est équipé d’une bosse cassante (Fig. 2-1) ; elles obligent parfois au ramendage ou même à la réparation de la structure métallique de la drague.
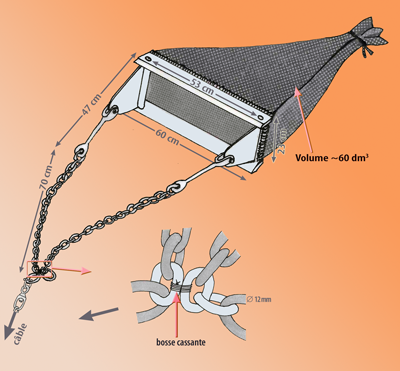
Figure 2-1 : Drague Charcot-Picard, avec caleçon. | 
Figure 2-2 : Retour sur le pont d’une drague Charcot-Picard sans caleçon (Photos extraites d’une vidéo). |
Draguer à grandes profondeurs, sur des pentes souvent rocheuses, demande de bien estimer les conditions du fond, notamment le substrat, le pente, le courant, ce qui peut aussi avoir des conséquences sur la sécurité du navire et des matelots et scientifiques au travail sur le pont (Emig, 1983, 1987). On peut citer comme exemple : la longueur du câble varie entre 2 et 3 fois la profondeur et elle dépend du traict en remontant la pente ou le long d’un isobathe, du vent en surface, de l’interprétation des données du sondeur, du substrat, etc. Avec une bonne habitude le toucher du câble renseigne sur le travail de la drague au fond et aussi pour adapter la vitesse du navire (de l’ordre de 1-1,5 nœuds) pour un maximum d’efficacité.
Petit chalut à perche (2 m de large)
Ce chalut n’a été utilisé qu’occasionnellement, car fragile (Fig. 2-3), il nécessite de fond meuble homogène sans grandes aspérités, ce qui est rare dans le bathyal supérieur des côtes provençal et corses. Il ressemble au gangui provençal à armature fixe, qui était utilisé à faible profondeur par les pêcheurs (un usage aujourd’hui pratiquement interdit pour les dégâts occasionnés dans les herbiers – soumis à dérogation).

Figure 2-3 : Petit chalut à perche – à gauche : sa mise à l’eau ; à droite : le nœud de raban-de-sac.
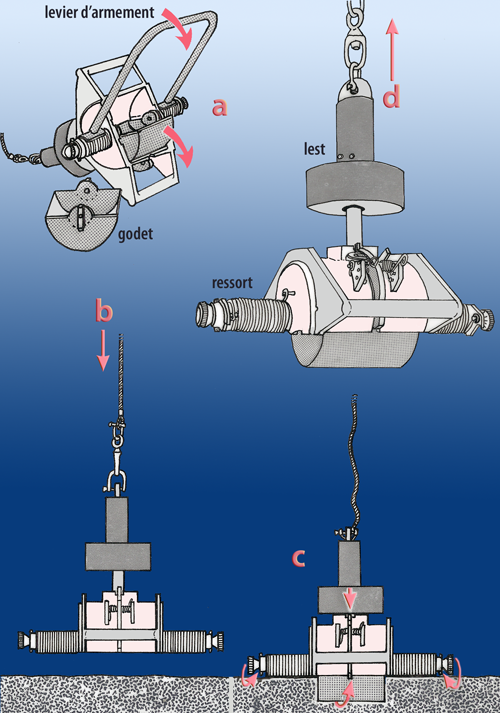 Benne Shipeck
Benne Shipeck
Cette benne a été choisie pour faire les prélèvements de sédiments meubles pour l’étude de leur granulométrie, ainsi que de la méiofaune. En anglais, elle est nommée Shipeck sediment sampler (Fig. 2-4). Le godet d’une dimension d’environ 20,5 x 20 cm pivote de 180° en touchant le fond et réalise ainsi le prélèvement. Sa mise à l’eau demande de l’attention pour ne pas déclencher prématurément la rotation.
Figure 2-4 : Benne Shipeck et sa mise en œuvre.
Modexa, (véhicule sous-marin téléguidé)
Ce ROV (Remotely Operated Vehicle ; Pl. 1) était un prototype apparu à l’époque des créations et mises au point de ce nouveau type de véhicule sous-marin, dont le but était de remplacer les submersibles sous-marins. Car ces derniers nécessitent des moyens lourds, tant techniques que financiers, dans leur mise en œuvre et donc ne sont pas facilement disponibles. Néanmoins, si un ROV est aujourd’hui d’une utilisation aisée et peu onéreuse, rien ne remplace une plongée humaine pour des observations in situ. Cette remarque a été déjà été faite début des années 1960 avec les premières observations et prélèvements scientifiques en plongée en scaphandre autonome (Emig, 1966).
Luge épibenthique.

Figure 2-5 : Luge épibenthique en cours de recueillement du prélèvement (à gauche) et prête pour la prochaine mise à l’eau.
La luge utilisée (Fig. 2-5), dérivée de celle d’Ockelmann, a été mise au point par Ledoyer (1987) pour la faune vagile épibenthique, notamment les crustacés (cumacés, amphipodes…).
Submersible sous-marin
Les plongées avec le submersible SMS Griffon, à partir du navire support BSM Triton (Pl. 1) étaient inscrites dans le cadre des aides à la recherche scientifique par la Marine Nationale française, à partir du port d’attache de Toulon. Les observations, faites lors des trois plongées effectuées en Provence (Tableau 1), se sont révélées primordiales dans l’étude de l’écologie et de la distribution des brachiopodes du Bathyal. En outre, chaque radiale (voir chapitres 8 et 9) avait été précédée par une intensive campagne de prélèvements, puis suivie par une autre pour échantillonner les zones ovservées lors des plongées.
Nota
Les engins utilisés ne permettent que des prélèvements qualitatifs sans donner la densité par m2. C’est dans les stations propectées en submersible, où des mesures de densité de Gryphus vitreus ont été effectuées visuellement, que les traicts avec la drague Charcot-Picard ont été étalonnés pour obtenir une extrapolation en fonction du nombre d’individus récoltés : chaque dragage se faisant à la même vitesse constante du navire pour une même durée de travail au fond (le toucher du câble renseigne parfaitement de l’arrivée sur le fond). En outre, lors de tous les dragages, le travail de l’engin au fond est très fréquemment contrôlé avec une main sur le câble de traction.
[1] Terme de pêcheur. Obstacle naturel immergé dans lequel se prend le filet ou l’engin (chalut, drague).
 |
|
| N/O Alciope (Marseille) | N/O Korotneff (Villefranche s/mer) |
|
|
|
| N/O Catherine-Laurence (Villefranche s/mer) | BSM Triton (Toulon), navire support du SMS Griffon |
   |
|
| N/O Antedon (Marseille) ROV Modexa (Marseille) SMS Griffon (Toulon) | |
Planche 1 : Principaux navires océanographiques utilisés au cours des campagnes en Provence et en Corse.
3. Histoire des échanges dans le domaine profond méditerranéen
Le rebord du plateau continental constitue une limite, séparant le domaine néritique du domaine profond, aussi importante que la ligne côtière. Ce rebord est défini par des caractéristiques à la fois géologiques, physico-chimiques et biologiques (Emig, 1997a). Le domaine profond est divisé en trois étages, dont l’extension et l’importance en mer Méditerranée diffèrent de ceux dans l’Océan Mondial (Fig. 3-1).
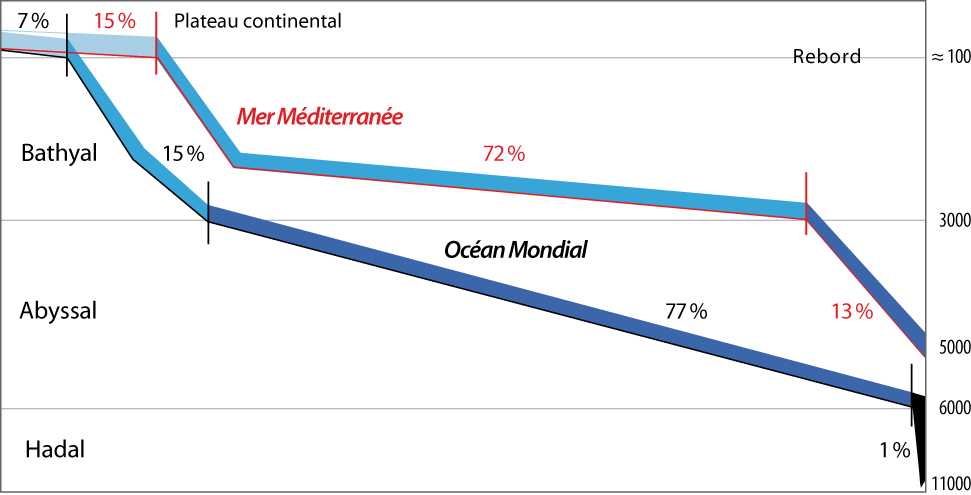
Figure 3-1 : Comparaison de l’extension, en pourcentage, des étages dans l’Océan Mondial et en la mer Méditerranée qui ne représente que 0,82 % de la superficie totale de l’Océan Mondial et 0,35 % de son volume. Le rebord du plateau continental (dont la profondeur est variable selon l’océan ou la mer pris en considération) marque la frontière entre les domaines néritique (plateau continental) et profond : il se situe vers cent, cent dix mètres en mer Méditerranée. À noter que la profondeur de deux cents mètres est une limite exclusivement économique et non scientifique, et ce n’est que dans ce contexte qu’elle devrait être mentionnée.
Le domaine profond méditerranéen reste mal connu, probablement parce que le benthos profond est caractérisé par une absence d’originalité et une pauvreté, dont les raisons sont à rechercher dans l’histoire récente de la faune (Di Geronimo, 1990 ; Laubier & Emig, 1993 ; Taviani, 2002 ; Emig & Geistdoerfer, 2004, 2008). Trois principaux types d’échanges en sont à l’origine :
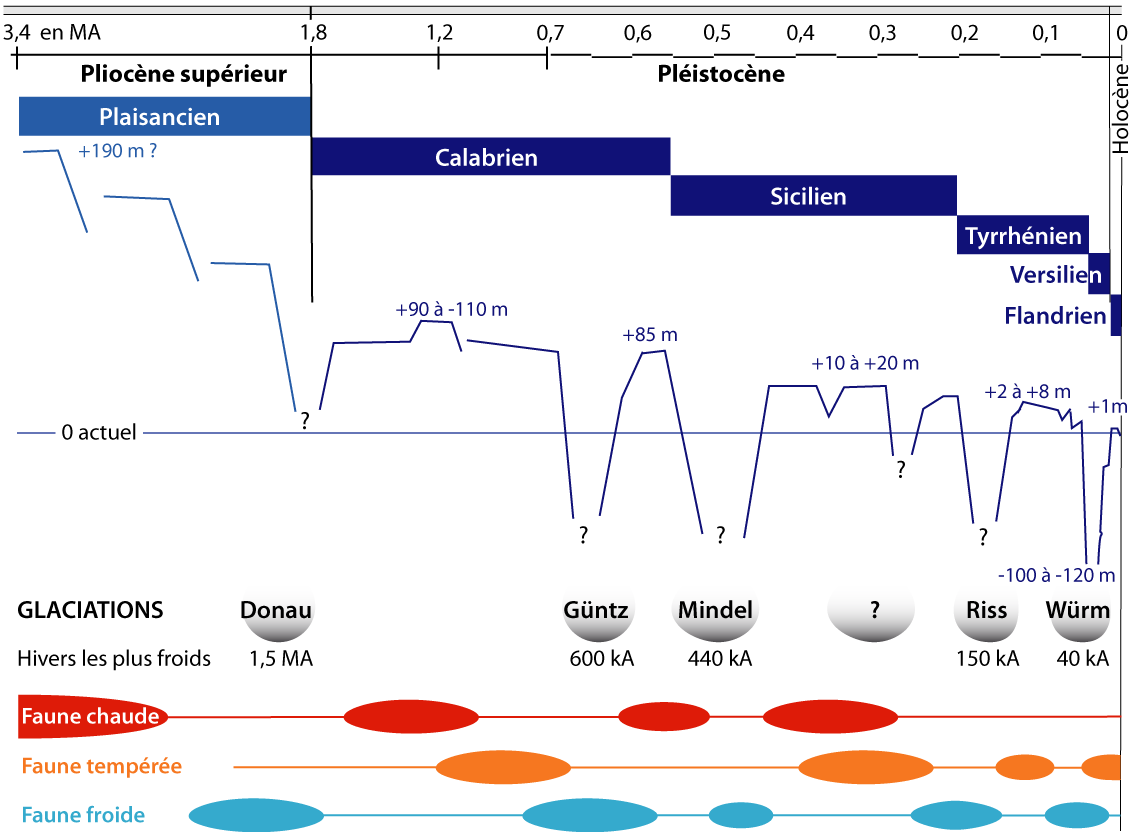
- les échanges historiques à travers les changements de faunes depuis le Pliocène et durant les fluctuations climatiques avec des successions de périodes glaciaires et interglaciaires (Fig. 3-2, 3-3) ;
- les échanges bathymétriques au sein des étages bathyal et abyssal soumis à des conditions très particulières (homothermie, relative oligotrophie, barrière du seuil de Gibraltar, circulation des masses d’eaux); plus profonde est l’extension des espèces en mer Méditerranée et plus large est leur distribution hors Méditerranée (Fig. 3-4) ;
- les échanges géographiques avec des affinités étroites entre les bassins occidentaux et orientaux de la mer Méditerranée et entre cette dernière et le proche océan Atlantique. Le cas des espèces endémiques reste un problème biogéographique. En général, les espèces ont toujours une distribution plus profonde en allant vers l’est et leur taille devient plus petite.
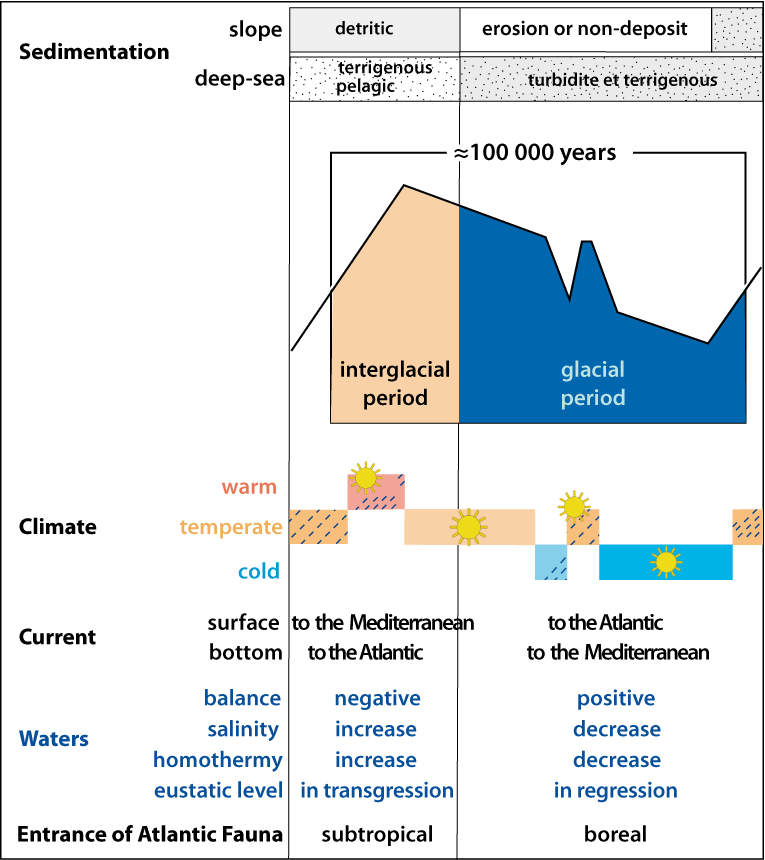
Ces échanges sont tous directement soumis aux caractéristiques du domaine profond méditerranéen, principalement à l’homothermie (de l’ordre de 13°-13,5°C dans le bassin occidental et 14°-15°C dans le bassin oriental), à une forte salinité (environ 38 à 38,5 psu [2]), à la stratification des couches d’eaux et à leur circulation barotropique, aux courants dans les détroits (Gibraltar et Siculo-tunisien) (Fig. 3-3).
Figure 3-2 : Principales phases de succession des faunes en mer Méditerranée depuis le Pliocène durant les diverses périodes glaciaires et interglaciaires (marquées par les variations du niveau de la mer) (modifié, d’après Laubier & Emig, 1993). Le nombre réel de glaciations au cours du Pléistocène reste à compléter, car il est possible qu’il y ait une ou deux autres glaciations entre celles de Mindel et de Riss. | ||
|
Figure 3-3 : Résumé des principales caractéristiques d’une glaciation quaternaire durant les périodes glaciaire et interglaciaire, en mer Méditerranée. |
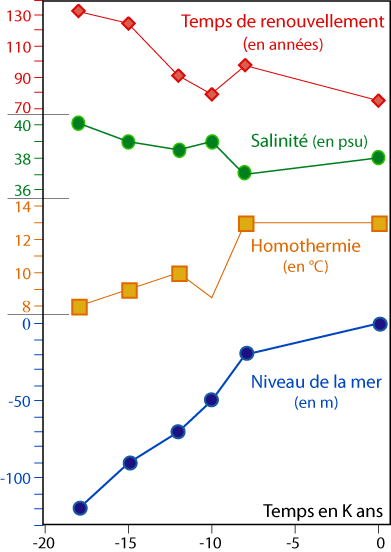
Figure 3-4 : Évolution paléo-océanographique des eaux du Bassin occidental de la Méditerranée depuis la dernière glaciation de Würm (d’après Poutiers, 1987). |
|
L’histoire océanographique de la mer Méditerranée a fait l’objet de nombreuses publications et de débats parfois contradictoires, notamment au sujet de la crise de salinité au Messinien. Les principales étapes de cette histoire ont été résumés par Laubier & Emig (1993), Emig & Geistdoerfer (2004, 2008).
La Méditerranée profonde actuelle apparaît comme une mer beaucoup plus jeune qu’aucune autre partie de l’Océan Mondial profond. Sa faune est principalement composée de groupes anciens (primitifs ?) au sein des embranchements, tandis qu’une fraction plus réduite comprend les types les plus spécialisés de leur groupe. C’est au niveau du rebord du plateau continental, agissant comme une frontière vers cent à cent dix mètres de profondeur, que se produit un important changement faunistique (Fig. 3-5, et 4-1, 4-2).
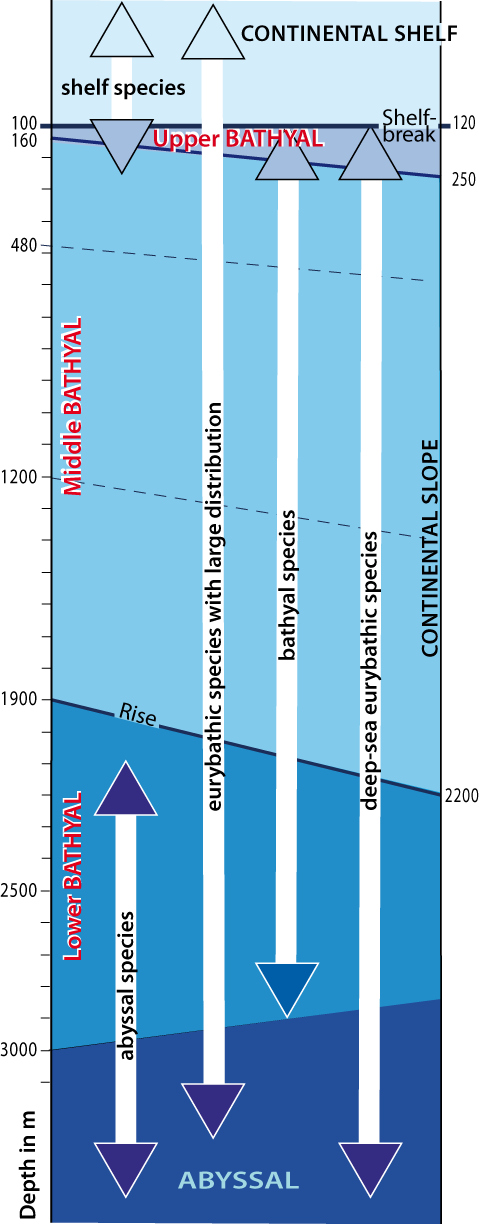
Figure 3-5 : Répartition bathymétrique des diverses catégories d’espèces (modifiée, d’après Carpine, 1970 ; Reyss, 1970) avec les limites de l’étage Bathyal (et de ses sous-étages (en trait pointillé les sous-limites dans le Bathyal moyen) et leurs variations.
Dans la distribution verticale du benthos profond méditerranéen, l’homothermie profonde est le facteur le plus important : il n’y a pas de variations de température pour limiter, en profondeur, la faune à divers niveaux comme dans l’océan Atlantique. Beaucoup d’espèces ne sont eurybathes en mer Méditerranée que parce qu’elles sont eurythermes ou sténothermes chaudes. Aussi, les limites de distribution sont régies par d’autres facteurs, tels que salinité, granulométrie, pression, nourriture disponible, hydrodynamisme. Et, cette variété de conditions locales conduit à un étage bathyal plus hétérogène que celui de l’océan Atlantique (Laubier & Emig, 1993 ; Emig, 1997a ; Emig & Geistdoerfer, 2004, 2008) (Fig. 3-5) ; ceci est lié à une distribution principalement en ceinture selon des isobathes.
Cette mer est un important centre d’évolution avec de futures spéciations et la création de nouvelles espèces endémiques à cause de ses particularités physiques à forts gradients.
[2] Selon les conventions internationales (UNESCO, 1985), les valeurs de salinité n’ont pas d’unité propre, les données sont exprimées en psu (= practical salinity unit).
4. Définition de l’étage Bathyal supérieur
La limite supérieure de l’étage Bathyal se situe au niveau du rebord du plateau continental : elle est définie non seulement par des caractéristiques morpho-géologiques, mais aussi physiques et biologiques des masses d’eau, du benthos et du pelagos (Fig. 4-1, 4-2). Malgré son importance primordiale, ce rebord étant une véritable frontière en raison des forts gradients qui s’y produisent, son environnement reste peu connu, car il se situe entre deux zones d’intérêt distinctes, l’environnement côtier et le domaine profond (Fig. 4-2) : il est comparable à la limite domaine marin – domaine terrestre. Il n'est donc pas surprenant que la transition du plateau au talus soit restée un « no man's land » biologique et physique (Vanney & Stanley, 1983 ; Vanney & Gennesseaux, 1988 ; Emig, 1997a).
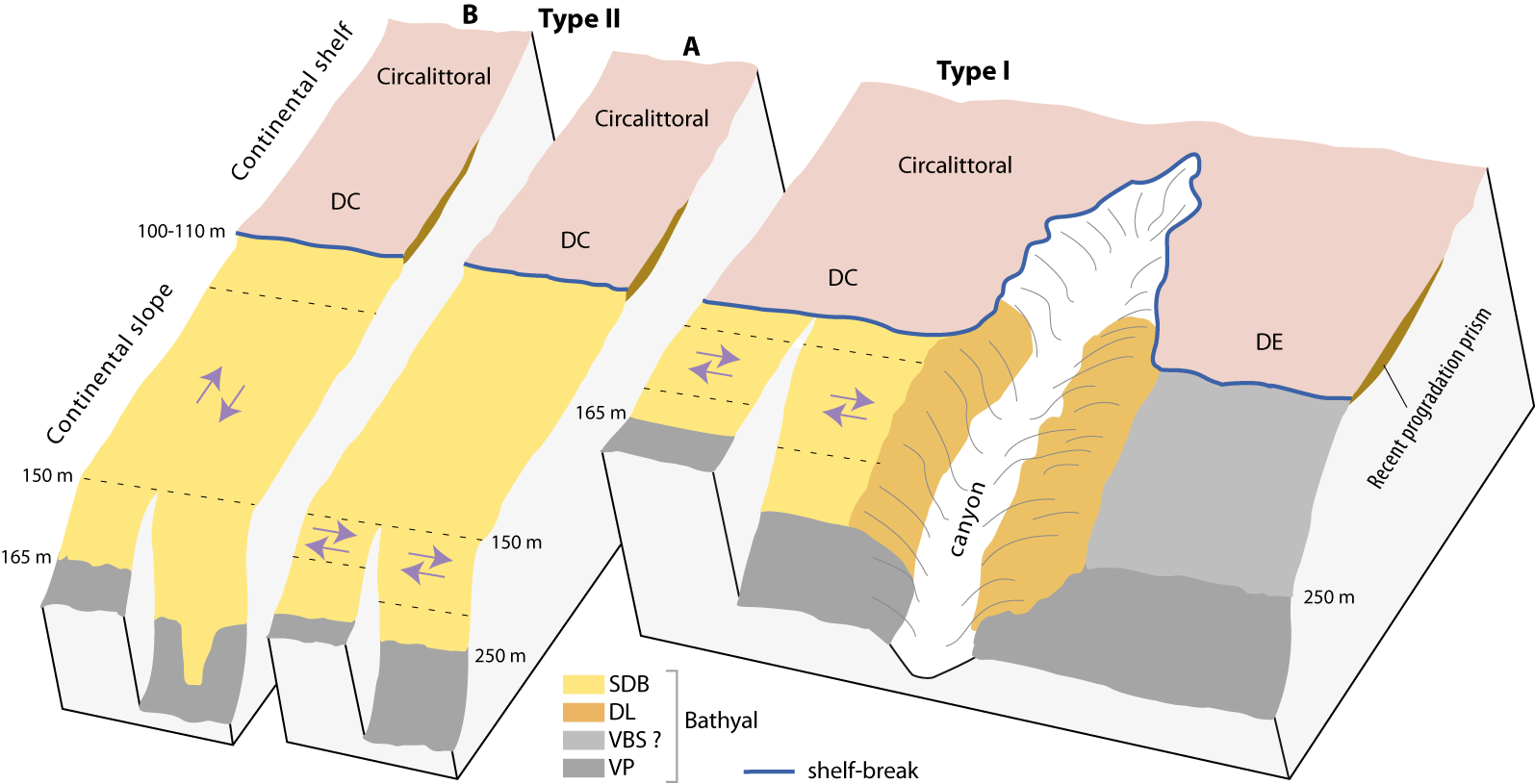
Figure 4-1 : Bloc-diagramme des deux grands types de profil (I et II) de la zone supérieure de l’étage Bathyal, avec la distribution des biocœnoses, en fonction de la pente et de la profondeur (d’après Emig, 1997a). Les flèches indiquent le sens des courants de fond dans les zones (entre pointillés) à densité maximale des brachiopodes où les courants sont les plus intenses – voir aussi Fig. 4-3. Biocœnoses bathyales (voir aussi Fig. 4-2) : SDB = b. des Sables Détritiques Bathyaux ; DL = b. du Détritique du Large ; VBS = b. de la Vase Bathyale Supérieure ; VP = b. de la Vase Profonde. Biocœnoses circalittorales : DC = b. du Détritique Côtier ; DE = b. du Détritique Envasé.
A. Caractéristiques morpho-géologiques
La morphologie de la zone du Bathyal supérieur, généralement des substrats meubles présente deux types principaux de profils (Fig. 4-1) sur lesquels la rupture de pente se produit à 100 à 120 m. Cependant, sur le profil de type II, on considérait généralement que la rupture du plateau continental se situait vers 150 m de profondeur, ce qui, en fait, correspond au rebord d'une grande terrasse plate bathyale; car la véritable limite continentale, souvent manquée, se situe vers le rivage et correspond au rebord d'un court déclivité d'environ 5 à 20 m (Fig. 4-1) (Emig, 1989a, 1989b, 1997a ; Savoye & Piper, 1993).
La limite inférieure de la zone bathyale supérieure est marquée par la « mud-line » suite à un changement brusque des conditions environnementales (Blake & Doyle, 1983) et sert de marqueur de niveau énergétique (Stanley et al., 1983 ; Emig, 1997a). Généralement située entre 160 et 300 m de profondeur selon le profil de la pente (Fig. 4-1, 4-2, 4-3), dont la morphologie régit l’influence des facteurs abiotiques dominants, on peut résumé par plus la pente est faible, moins la mud-line est profonde (Emig, 1989a, 1989b). Ainsi, se confirme que les limites de l’étagement benthique ne peuvent être définies par la seule bathymétrie, mais selon un ensemble de facteurs.
L'empreinte récente, depuis la dernière élévation du niveau de la mer (glaciation de Würm ≈ 17 000 ans), apparaît clairement dans le Bathyal supérieur : le rebord de la plateforme continentale se situe à la limite extérieure des dépôts formant un prisme progradant (Fig. 4-1). Le bord du plateau est en équilibre avec les conditions environnementales actuelles; sa progradation durant l'Holocène tardif a été négligeable et sa profondeur coïncide avec un niveau « d'équilibre de déposition » (Mougenot et al., 1983 ; Monaco et al., 1990 ; Courp & Monaco, 1990 ; Savoye & Piper, 1993). L'absence relative de sédiments récents dans le Bathyal supérieur montre que les sédiments sont principalement des sédiments résiduels (Würmien) retravaillés avec des thanatocœnoses quaternaires visibles par submersibles et généralement situées entre 180 et 200 m de profondeur (Gautier & Picard, 1957 ; Blanc, 1968 ; Emig & Arnaud, 1988 ; Emig & García-Carrascosa, 1991 ; Emig, 1997a).
B. Caractéristiques physiques
La zone bathyale supérieure est un secteur à haute énergie caractérisé par des variations de gradient des facteurs abiotiques dominants, à savoir hydrodynamique, salinité, température, oxygène, sédiments (Fig. 4-2). Dans tout le bassin nord-ouest, il existe un courant principal, le courant liguro-provençal-catalan, qui suit la rupture du plateau continental et coïncide avec un front de densité de plateau/pente permanent ; ce flux est intensifié par les vents dominants et sépare les masses d’eaux continentales du plateau de celles profondes du talus continental (Salat & Font, 1987 ; Millot, 1987 ; Wang et al., 1988 ; Emig, 1989b ; Monaco et al., 1990 ; Font, 1990 ; Emig & García-Carrascosa, 1991 ; Huthnance, 1992).
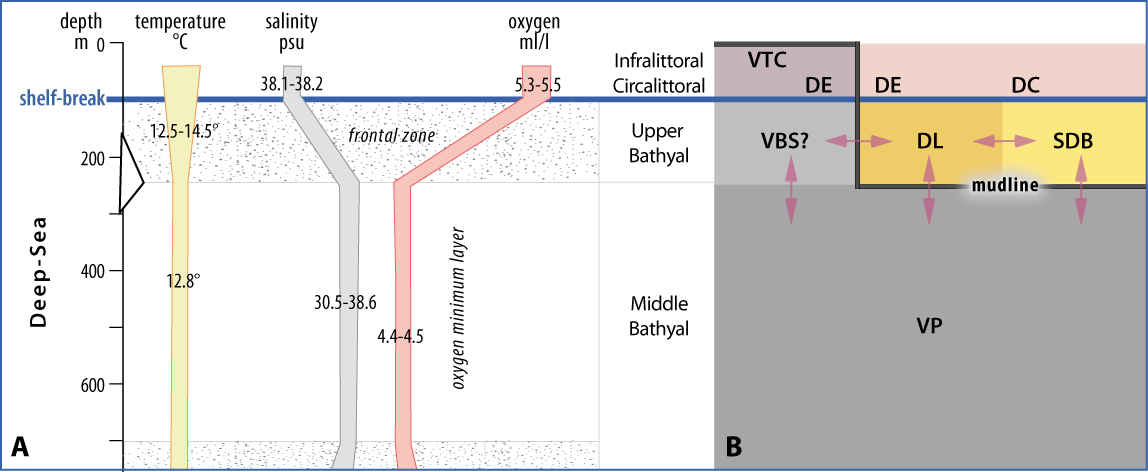
Figure 4-2 : A. Diagramme des différents paramètres de la colonne d’eau dans l’étage Bathyal (d’après Emig, 1997a). B. Distribution des biocœnoses circalittorales et bathyales le long du talus continental avec les limites et les relations de la faune benthique. Biocœnoses : DC - du Détritique Côtier, DE - du Détritique Envasé, DL - du Détritique du Large, SDB - des Sables Détritiques Bathyaux, VBS - de la Vases Bathyales Supérieure, VP - de la Vase Profonde, VTC - de la Vase Terrigène Côtière.
Le courant proche du fond, faible ou absent sur la partie inférieure du plateau continental, augmente en plusieurs dizaines de mètres dès le rebord du plateau ; son extension bathymétrique, sa vitesse et sa direction sont directement liées à la physiographie de la pente (Fig. 4-1). La vitesse montre un gradient vertical et varie d'environ 0,5 à 2 nœuds ou plus, parfois responsable de grandes rides ou ondulations sur les fonds (Emig, 1987). Par conséquent, la sédimentation est absente ou faible dans le Bathyal supérieur, qui semble être une zone de remise en suspension avec une accumulation mineure de particules et dans laquelle la faune se caractérise par de fortes densités de suspensivores. À la limite inférieure de cette zone, la vitesse du courant de fond s'arrête sur plusieurs dizaines de mètres tandis que le substrat devient vaseux (Emig, 1997a) : c’est la mudline (Fig. 4-1 à 4-3).
La colonne d'eau surmontant le Bathyal supérieur dans le nord-ouest de la mer Méditerranée est caractérisée par plusieurs gradients (Fig. 4-2) : faible variation annuelle de la température (environ 2°C) qui devient constante (homothermie profonde) au-delà d'environ 200 m de profondeur, augmentation de la salinité et forte diminution de l'oxygène dont la teneur est cependant supérieure à la consommation biologique. Dès la limite inférieure de la structure frontale, les propriétés hydrologiques changent fortement (Huang & Su, 1991), notamment par la couche d’oxygène minimum liée à la masse d’eau intermédiaire levantine, un maximum de salinité et une homothermie (Fig. 4-2). Le rapport C/N dans les sédiments diminue de 12 à 10 (Carpine, 1970 ; Emig, 1997a).
C. Caractéristiques biologiques
L’étage Circalittoral s'étend jusqu’à la limite inférieure des algues multicellulaires (Pérès & Picard, 1964 ; Picard, 1971 ; Bellan-Santini et al., 1994) : à partir d’observations submersibles sur la biocœnose du Détritique Côtière (DC), les algues rouges calcaires ne dépassent pas le seuil et, après une courte période transitoire de à quelques dizaines de mètres, débute la biocœnose des Sables Détritiques Bathyaux (SDB) débute, ou sur les flancs des canyons sous-marins, la biocœnose du Détritique du Large (DL) (Fig. 4-1, 4-3). La DL a été traditionnellement considérée comme une biocœnose circalittorale, parfois confondue avec la SDB, mais les deux appartiennent sans aucun doute au Bathyal supérieur (Laubier & Emig, 1993). Le bord du plateau continental correspond à la limite supérieure de la distribution d'au moins deux espèces bathyales supérieures exclusives, le brachiopode Gryphus vitreus dans la SDB et le crinoïde Leptometra phalangium (Müller, 1841) dans la DL, tandis que la mudline marque la limite de leur extension en profondeur.
Le substrat de la SDB est un sédiment sableux fin à grossier bien trié, colmaté par une fraction fine pouvant atteindre 60% et contenant une grande proportion détritique de petits substrats durs d’origine endogène (fragments de coquilles de mollusques et de brachiopodes, d’éponges, de bryozoaires, de coraux) et des graviers, des cailloux ; cette fraction détritique est une caractéristique de la SDB (Falconetti, 1980 ; Emig, 1989a, 1989b).
Le substrat de la DL est une vase sableuse (gravier, sable, vase) (Picard, 1965; Emig, données non publiées).
La faune benthique de ces biocœnoses a été décrite par Pérès & Picard (1964), Picard (1965), Falconetti (1980), Pérès (1982, 1985) et récemment par Grinyó et al. (2018).
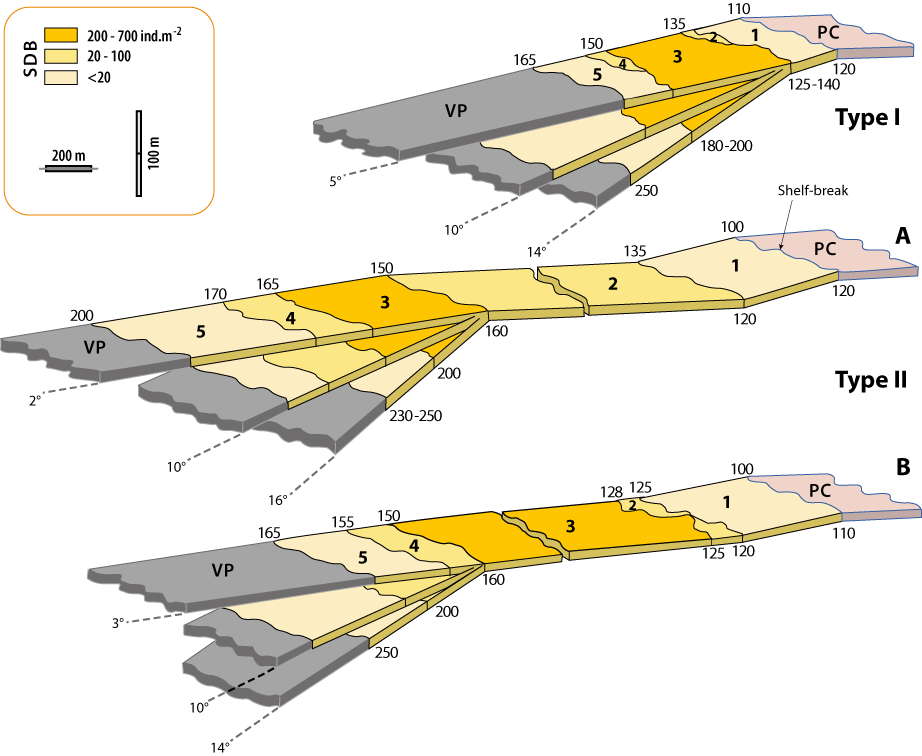
Figure 4-3 : Zones de densité (1-5) de Gryphus vitreus selon les deux types de profil (I et II) rencontrés lors des campagnes en mer. PC : plateau continental (Circalittoral); VP: biocœnose de la Vase Profonde; SDB : biocœnose des Sables Détritiques Bathyaux (d’après Emig, 1989b).
L’étage Bathyal affleure dans des gisements fossiles en Italie, notamment en Calabre et en Sicile ; ils ont été décrits par divers auteurs, mais nous ne retiendrons ici que quelques travaux concernant en même temps des brachiopodes : Seguenza (1871), Di Geronimo (1979, 1984, 1987), Barrier (1984), Gaetani & Saccà (1984), Saccà (1986, 1992), Taviani (2002), Taddei Ruggiero & Taddei (2006), Ruggiero & Raia (2010).
Sur substrats vaseux (Fig. 4-2B, 4-4, 4-5), la transition entre les biocœnoses circalittorales du Détritique envasé (DE) et de la Vase Terrigène Côtière (VTC) et celles de l’étage Bathyal, pourrait se faire par la biocœnose de la Vase Bathyale Supérieure (VBS) qui reste néanmoins hypothétique en raison du manque d'investigations. Cependant, d'après les données de Guille (1970), Picard (1971), Salen-Picard (1982), Albertelli et al. (1991) et Albertelli & Fraschetti (1992), il existe bien un changement faunistique au niveau du rebord du plateau avec l'apparition d'espèces dominantes (Fig. 4-4), en particulier l'ophiuride Amphiura filiformis (Müller, 1776), atteignant 8-34% de la faune selon Salen-Picard (1982) et Albertelli et al . (1991), et le polychète Maldane glebifex Grube, 1860, tandis que les espèces caractéristiques des biocœnoses circalittorales DE et VTC sont absentes dans le Bathyal supérieur ; certaines espèces peuvent y atteindre des densités élevées dans certaines régions, comme l'échinoderme Brissopsis lyrifera Forbes, 1841, le pennatulaire Funicula quadrangularis (Pallas, 1766), l'éponge Thenea muricata (Bowerbank, 1858).
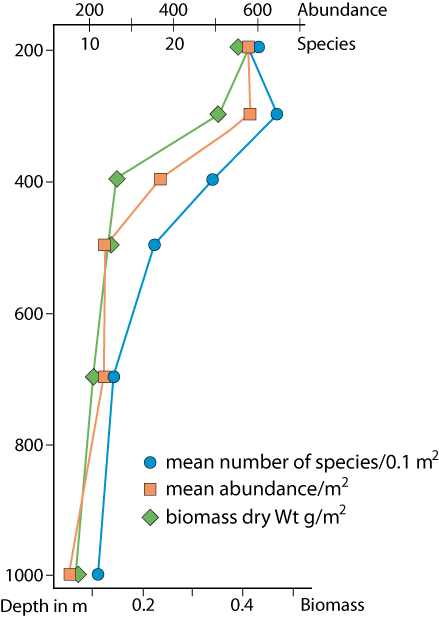
Figure 4-4 : Richesse spécifique, abondance et biomasse de la macrofaune le long d’une radiale sur la pente continentale en Crête (d’après Tselepides & Eleftheriou, 1992).
Rappelons pour clore ce chapitre que les caractéristiques biologiques ne sont qu’un des aspects permettant de définir une biocœnose [3], l’autre étant le biotope [4] dont les facteurs abiotiques sont aussi régis par la géomorphologie (et physiographie). Il est donc nécessaire de prendre en considération les données de l’océanographie physique, chimique et géologique, incluant la géomorphologie, ce que les océanographes biologiques ont trop souvent négligé, voire ignoré. Car ce n’est qu’avec des résultats pluridisciplinaires concomitants que l’étagement benthique peut ou doit être défini. En outre, quand on entre dans le domaine profond, il est primordial de situer avec précision sa limite supérieure, donc le « vrai » rebord du plateau continental. La méconnaissance de cette limite et de la zone sous-jacente avec ses caractéristiques à fort gradient avait conduit certains auteurs, à considérer le Bathyal supérieur comme une zone de transition (Ercegovic, 1957 ; voir chapitre 7). L’analyse des résultats obtenus dans cette zone demande un échantillonnage précis, car le passage au domaine profond depuis le plateau peut se faire en seulement quelques dizaines de mètres. Pour les brachiopodes (Emig, 1988, 2016, 2017a), comme pour d’autres suspensivores, l’hydrodynamisme dans le Bathyal supérieur est particulièrement propice à une distribution à forte densité.
Evolution de la présence des brachiopodes dans les biocœnoses
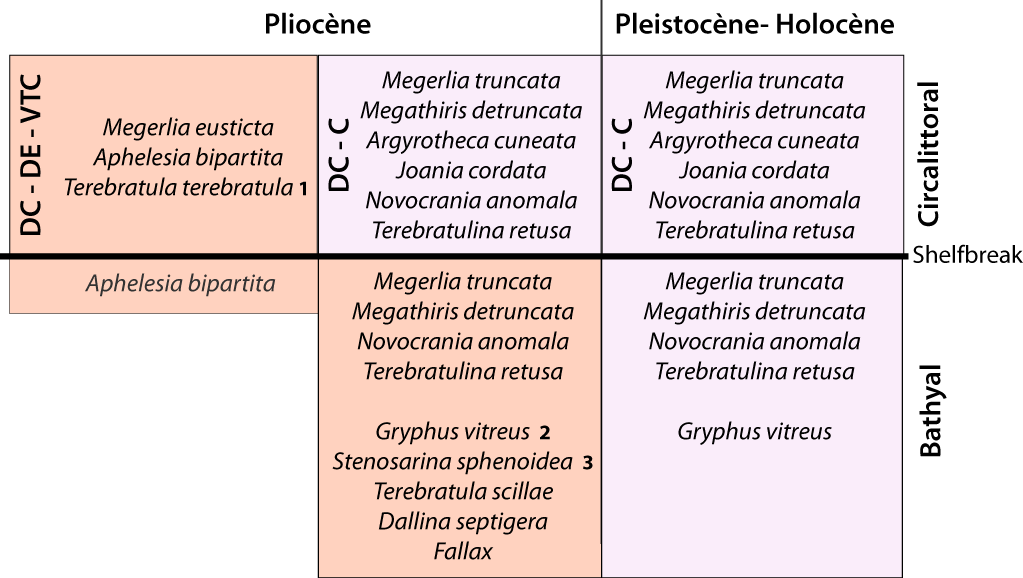
C’est vers la fin du Pliocène que s’opèrent progressivement quelques changements au sein des brachiopodes.
Figure 4-5 : Présence des brachiopodes dans les biocœnoses des étages Circalittoral (plateau continental) et Bathyal, du Pliocène à nos jours, dans le Bassin Occidental Méditerranéen. 1.- Synonyme : Terebratula calabra Seguenza, 1871 ; 2.- Incluant G. minor Philippi, 1836 ; 3.- Stenosarina sphenoidea (Philippi, 1844) (= former Stenosarina davidsoni Logan, 1998) - voir Emig (2017a). Abréviations des biocœnoses méditerranéennes : DC = Détritique Côtier ; DE = Détritique Envasé ; VTC = Vase Terrigène Côtière ; C = Coralligène. Les espèces fossiles sont celles citées dans des travaux de paléoécologie, alors qu’il existe une longue liste de variétés et d’espèces pouvant leur être référables dans les travaux de systématique (voir Appendice B).
[3] Biocœnose : ensemble des populations liées par une dépendance réciproque et se maintenant de manière permanente et se reproduisant dans un biotope (voir Arnaud & Emig, 1987).
Population : ensemble d'individus d'une même espèce vivant en un même lieu.
[4] Biotope : espace de vie d'une biocœnose, défini et délimité par la constance relative de ses facteurs abiotiques ou la prévisibilité de ses fluctuations.
5. Les espèces de brachiopodes du Bathyal méditerranéen français
En mer Méditerranée, avec la création de stations marines universitaires à la fin du XIXe siècle, la proximité de la pente continentale par rapport à la côte a facilité les dragages profonds à partir du Laboratoire Arago [5] (Banyuls), de la Station Marine d’Endoume [6] (Marseille), de la Station Biologique de Villefranche-sur-mer [7] et du Musée Océanographique de Monaco[8] (Fig. 5-1, 5-2), ainsi que les plongées en submersible sur les fonds à brachiopodes depuis Toulon [9]. A l’exception du Golfe du Lion, la largeur du plateau continental se situe entre quelques centaines de mètres et quelques milles marins, alors que la limite des eaux territoriales est de 12 milles en mer Méditerranée, au-delà ce sont les eaux internationales. Depuis plus de deux siècles, les brachiopodes méditerranéens actuels et fossiles ont été largement échantillonnés et étudiés peut être plus que dans d’autres zones équivalentes en surface (Tableau 2).
Il faut souligner que nombre d’espèces marines présentes en mer Méditerranée vivent aussi dans l’Océan Atlantique ou y ont des formes vicariantes, généralement avec une distribution bathymétrique moins profonde (Laubier & Emig, 1993 ; Emig & Geistdoerfer, 2004, 2008).
Tableau 2 : Liste des brachiopodes des côtes françaises méditerranéennes (par ordre systématique, récoltés dans le Bathyal, avec l’intervalle bathymétrique connu pour chaque espèce et leur présence en Manche et dans l’océan Atlantique (voir Emig, 2016, 2017a ; et chapitre 9). R- = Rhynchonellata. * Nombre de références pour chacune de ces espèces en mer Méditerranée sur la totalité des références citant l’espèce (d’après ma base de données bibliographiques) ; ces références ont servi à établir les cartes de distribution en mer Méditerranée (voir Fig. 5-3 à 5-9; et Emig, 2018 ; Emig et al., 2018).
|
Méditerranée
|
Manche
|
Atlantique
|
Bathymétrie connue (en m) | connue depuis | Classification | Références * |
| Novocrania anomala | quelques m - 1478 | Oligocène | Craniida | 131 / 285 | ||
| Gryphus vitreus | 78 - 2678 | Miocène | R-Terebratulidina | 132 / 232 | ||
| Terebratulina retusa | 9 - 3614 | Miocène | R-Terebratulidina | 109 / 335 | ||
| Megathiris detruncata | 5 - 896 | Éocène | R-Terebratellidina | 90 / 164 | ||
| Platidia anomioides | 8 - 2190 | Miocène | R-Terebratellidina | 60 / 159 | ||
| Megerlia truncata | 10 - 1970 | Miocène | R-Terebratellidina | 120 / 236 |
La classification, proposée ci-dessous, est celle à jour dans la Brachiopoda Database [http://paleopolis.rediris.es/brachiopoda_database/index.html], voir aussi Emig et al. (2013). Les espèces bathyales de brachiopodes, connues en mer Méditerranée et citées dans le Tableau 2, sont aujourd’hui toutes bien décrites par leurs caractères (voir Logan, 1979 ; Boullier et al., 1986 ; Álvarez & Emig, 2005, Emig, 2010, 2013, 2014, 2016). Néanmoins, la seule espèce exclusivement bathyale, au moins en mer Méditerranée, est Gryphus vitreus, tandis que les autres vivent aussi dans des biocœnoses du plateau continental, mais avec des densités maximales dans l’étage Bathyal. Toutes sont connues sous forme fossile (Tableau 2). Bien des auteurs, notamment paléontologues, principalement italiens, français et allemands, les ont parfois décrites sous diverses variétés ou espèces, principalement sur des différences de et dans la coquille, qui ne sont pas toutes des caractères taxinomiques, mais n’en sont que des variations, cette façon de faire de la systématique encore en vigueur de nos jours mérite nécessite une explication (voir Appendice A).
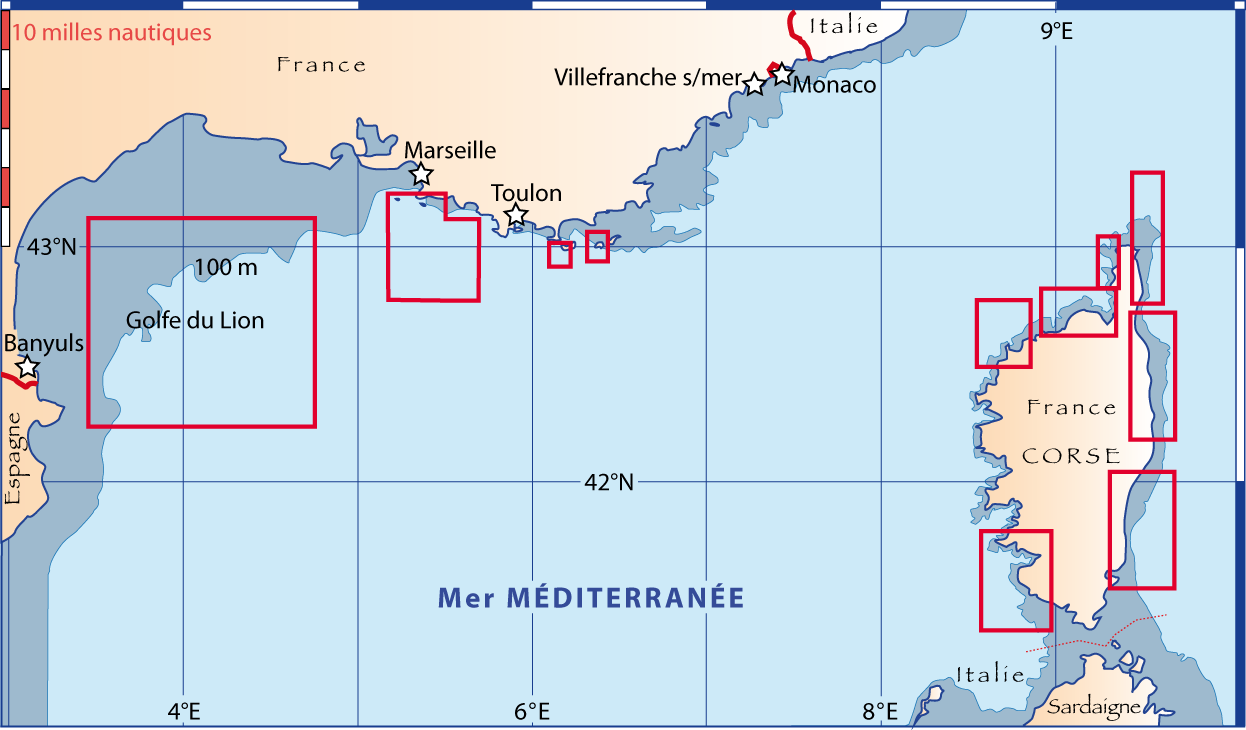
Figure 5-1 : Carte générale des zones des campagnes en mer pour étudier la distribution des brachiopodes le long des côtes françaises (pour plus de détails voir Matériel et les Annexes). Les étoiles situent les laboratoires marins, dont trois du CNRS-Université, et l’Arsenal de Toulon pour les plongées en submersible (voir texte et notes).
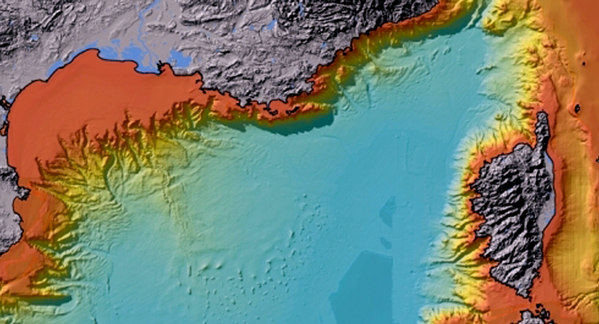
Figure 5-2 : Carte de la Commission de la Carte Géologique du Monde (Paris), montrant le relief sous-marin (reproduit avec l'autorisation de la CCGM - http://www.ccgm.org).
En plus, la systématique et distribution biocœnotique des brachiopodes fossiles et actuels en mer Méditerranée doivent s’étudier en prenant en compte l’histoire géologique toute particulière et complexe de cette mer, principalement depuis le début du Néogène. Or, elle est souvent méconnue tout comme les concepts de la bionomie benthique méditerranéenne. C’est, pour ne pas l’avoir prise en considération, que certains auteurs récents, comme Cohen et al. (2014) ou Robinson (2014, 2017), en sont arrivés à des conclusions qui ne sont pas cohérentes avec l’écologie des brachiopodes méditerranéens et de leurs espèces vicariantes atlantiques. Les seuls caractères de la coquille sont insuffisants pour décrire une nouvelle espèce quand leurs variations n’ont pas été étudiées et formellement identifiées, tout comme la non-prise en compte de la distribution biocœnotique d’une population [3], [4], ce qui est fondamental en bionomie benthique méditerranéenne tant pour les espèces actuelles que fossiles.
En outre, la bibliographie de ces espèces pourtant fort importante (Tableau 2) comporte principalement des auteurs du pourtour méditerranéen ; quant aux auteurs anglophones, ils « oublient » souvent de lire et de citer les travaux de ces auteurs qui, évidemment, n’écrivent pas en anglais. Cette situation dure depuis le XVIIIe siècle, comme le mentionne Emig (2012) sur les descriptions de brachiopodes par le Nissart Giuseppe Antonio Risso (1777-1845).
Les Brachiopodes ne font pas l’objet d’une rediscription ici, car au cours des prélèvements, leur identification est facile à faire. Néanmoins, Gryphus vitreus a été intensivement étudié pour les variations de certains caractères, variations parfois considérées elles-mêmes par les paléontologues comme des caractères valides. Les résultats ont servi ensuite à reconsidérer le statut d’autres espèces fossiles, notamment du Mésozoïque, tout comme la systématique stratigraphique. Malgré une attention toute particulière pour d’autres espèces de petite taille, telles que Argyrotheca et Lacazella, aucun individu n’a été récolté lors des campagnes listées sur le Tableau 1 (voir aussi chapitre 8).
Enfin, à l’exception de Gryphus vitreus qui vit sur un substrat meuble, toutes les autres espèces de brachiopodes sont fixées sur un substrat dur, généralement rocheux ou biologiques.
Phylum Brachiopoda
Sous-phylum Craniiformea
Classe Craniata
Ordre Craniida
Super-famille Cranioidea
Famile Craniidae
Novocrania Lee et Brunton, 2001
Synonymes : Criopus Poli, 1791 ; Criopoderma Poli, 1795 ; Orbicula Cuvier, 1798 ; Orbicularius Duméril, 1805 ; Cryopus Deshayes, 1836 ; Criopododerma Agassiz, 1846 ; Neocrania Lee et Brunton, 1986 ; voir aussi Álvarez et al. (2005, p. 216), Emig (2018), Emig et al. (2018).
Novocrania anomala (Müller, 1776) [Patella anomala Müller, 1776]
Synonymes : Anomia turbinata Poli, 1795 ; Orbicula anomala : Cuvier (1798) ; Orbicula norwegica Lamarck, 1801 ; Criopus anomalus : Fleming (1822) ; Anomia norwegica : Wood (1828) ; Crania anomala : Lovén (1846) ; Neocrania anomala : Lee et Brunton (1986).
Localité-type : Hår-Krøllen (Danemark).
Distribution : Fig. 4-5, 5-3, Pl. 2 ; voir chapitres 8 et 9.
Novocrania turbinata (Poli, 1795), décrite dans l’étage Bathyal des eaux du Royaume des Deux-Siciles (Italie), est synonyme de N. anomala, comme l’a récemment démontré Emig (2014). En fait, cette espèce fut toujours considérée par les auteurs comme la variété méditerranéenne ou vicariante de N. anomala, à l’exception de rares paléontologistes, dont Brunton (1989), Logan & Long (2001) ou Robinson (2017). C’est ainsi que ce dernier auteur suggère que la « variété turbinata » soit élevée au rang d’espèce, mais sans en apporter les preuves phylogénétiques par une analyse cladistique de nouveaux caractères, ni répondre à mes remarques antérieures (Emig, 2014). Or, une différence dans les caractères taxinomiques entre anomala et turbinata, tant actuelle que fossile n’a jamais été établie, sauf de possibles variations d’un caractère. Logan & Long (2001) mentionne que les différences entre les deux supposées espèces sont : « mainly in the degree of calcification of the valves and the relative development and placement of the dorsal valve muscle scars. » ; or, ces caractéristiques peuvent être interprétées comme des simples variations, en tout cas ils ne sont pas suffisant, sauf à prouver qu’il s’agit de caractères phylogénétiques (d’où l’attente d’une analyses cladistique). Et pour être complet, ces auteurs mentionnent ensuite : « Neither the shell morphology nor geographical distribution of the two forms appears to be the result of ecological factors, such as depth or hydrodynamic action. », mais il leur reste à le prouver, car ce n’est aujourd’hui qu’une supposition. Comme ces auteurs, Robinson (2017) est resté cantonner sur des descriptions de la seule coquille sans prendre en compte ni l’anatomie, ni l’histoire, ni la distribution de N. anomala pour la dite variété turbinata (Fig. 5-3) : comment cet auteur peut-il expliquer que, dans les environs de Marseille, il identifie un ou deux exemplaires de N. anomala et de N. turbinata attribuant les exemplaires de Logan (1979) à la première espèce et à mes exemplaires à la seconde d’après mes seules photographies publiées (Emig, 2014), alors qu’il s’agit probablement, dans ce cas précis, des exemplaires de mes propres récoltes. En outre, Robinson (2017) a oublié de s’intéresser aux formes fossiles de N. anomala, connues depuis l’Oligocène dans le domaine méditerranéen (Bitner et al., 2013), sauf à mentionner qu’en l’absence de matériel les identifications demeure problématique ! En revanche, Cohen et al. (2014) rejetent la « traditional morphology » tout en l'utilisant pour identifier le matériel sur lequel ils ont fait les analyses moléculaires (Emig, 2014).
Avoir deux espèces d’un même genre dans la même niche n’est possible, bien qu’exceptionnel, qu’en ayant des différences importantes, notamment dans l’éthologie et la reproduction (maturation des gonades, type larvaire…). Rappelons que des caractères écologiques peuvent aussi être des caractères taxinomiques surtout quand on travaille sur des espèces vivantes (voir Appendice A). Ces remarques peuvent aussi se répéter pour les synonymes de Megerlia truncata et de Platidia anomioides.
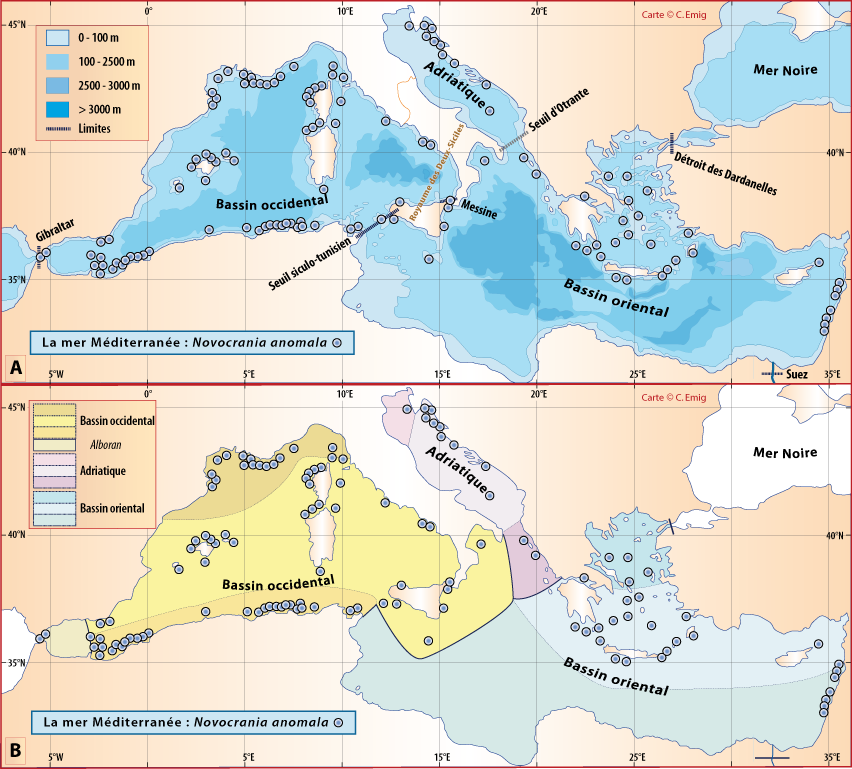
Figure 5-3 : Répartition de Novocrania anomala en mer Méditerranée (Emig, 2014). A. En fonction de la géographie et de la bathymétrie, avec les principales limites dans les échanges des masses d'eaux, qui ont évolué depuis le Miocène. B. En fonction des zones faunistiques dans les différents bassins (modifiée, d'après Carpine, 1970). La circulation des masses d'eau et les variations du niveau de la mer au cours des glaciations sont des facteurs primordiaux dans l'évolution des faunes méditerranéennes (Emig & Geistdoerfer, 2004).
Faire appel à la génétique ne permet pas de résoudre le problème, car l’identification des spécimens n’est basée que sur la morphologie de la coquille et en rien sur l’anatomie, alors que justement la génétique n’utilise que les parties molles. Aussi, considérerons-nous qu’il n’existe à ce jour qu’une seule espèce de Novocrania en mer Méditerranée, qu’elle soit nommée N. anomala ou N. turbinata, mais, dans ce dernier cas, il faudra établir une diagnose [10] sur des caractères phylogénétiques avec leur variations au-delà de ceux que la seule coquille, ce qui n’est pas toujours techniquement à la portée des paléontologistes. Pourtant, ces derniers « négligent » les caractères anatomiques, ce qui entraîne l’impossibilité de faire une analyse cladistique. Il reste à entreprendre une étude approfondie des variations des caractères taxinomiques (incluant l’anatomie et l’écologie) de N. anomala au sein des différentes populations méditerranéennes et de les comparer avec ceux d’exemplaires provenant de Sicile (Fig. 5-3), pouvant être considérés comme pouvant se rapporter à N. turbinata ; en outre, plusieurs dizaines d’exemplaires de diverses provenances sont nécessaires à l’étude des caractères.
D’après nos récoltes (incluant de nombreuses observations en plongée en scaphandre autonome), N. anomala vit sur substrat dur (rocheux) depuis quelques mètres de profondeur jusque vers 280 m (Emig, 1997b) ; au-delà, il devient impossible d’échantillonner le long des tombants et autres structures rocheuses profondes, et donc de savoir si sa distribution est plus profonde. Elle est présente dans différentes biocœnoses des étages infralittoral, circalittoral et bathyal (Fig. 4-5): rappelons que l’écologie doit être prise en compte en taxinomie. N. anomala est parfois abondante, notamment avec Terebratulina retusa, et aussi la présence de Gryphus vitreus et Megerlia truncata, dans la biocoenose bathyale des Coraux blancs profonds (aussi nommée « community of Cold-Water Corals ») (Pérès, 1982, 1985 ; Taviani et al., 2017).
Sous-phylum Rhynchonelliformea
Classe Rhynchonellata
Ordre Terebratulida
Sous-ordre Terebratulidina
Super-famille Terebratuloidea
Famille Terebratulidae
Sous-famille Gryphinae
Gryphus Megerle von Mühlfeldt, 1811
Synonymes : non Gryphus Brisson, 1760 ; Liothyris DouvilIé, 1880 (non Conrad, 1875) ; Liothyrina Œhlert, 1887 ; voir aussi Álvarez et al. (2005, p. 219), Emig (2018), Emig et al. (2018).
Gryphus vitreus (Born, 1778) [Anomia vitrea Born, 1778]
Synonymes : Terebratula vitrea : Lamarck (1801) ; Terebratula minor Philippi, 1836 : Gaetani & Saccà (1984) ; Appendice B. – forme fossile pliocène Terebratula affinis Carus (1893) ; Eurysina minor : Cooper (1983).
Localité-type: Port-Mahon, Minorque (Iles Baléares, Espagne).
Distribution : Fig. 4-3, 4-5, 5-4, Pl. 2 ; voir chapitres 8 et 9.
Gryphus vitreus est connu depuis le Miocène en mer Méditerranée, notamment dans les gisements fossiles bathyaux en Italie ; parfois de petits spécimens ont aussi été nommés Gryphus minor qui a fait l’objet de nombreux débats au sein des paléontologues quant à son statut (voir Appendice B).
La distribution de cette espèce a fait l’objet de recherches intensives tant le long des côtes du Languedoc et de Provence que de Corse. Outre les données des campagnes BraProv, BraCorse et Bathymed, des données récentes fournies par J. Martin (Ifremer, Nantes) et par A. Jadaud (Ifremer, Sète) ont été obtenues lors des campagnes « Meditis » 2012-2014 (Tableaux 1, 10). Les résultats ont fait l’objet de nombreuses publications tant sur sa distribution géographique et bathymétrique (voir Emig, 1985a, 1988, 1989a, 1989b, 1989c, 1997a, 2017a), avec aussi une dizaine de radiales suivies par dragages sur plusieurs années et dont trois ont été parcourues en submersible sur toute leur longueur (Emig, 1987 ; Emig & Arnaud, 1988 ; Emig & García-Carrascosa, 1991).
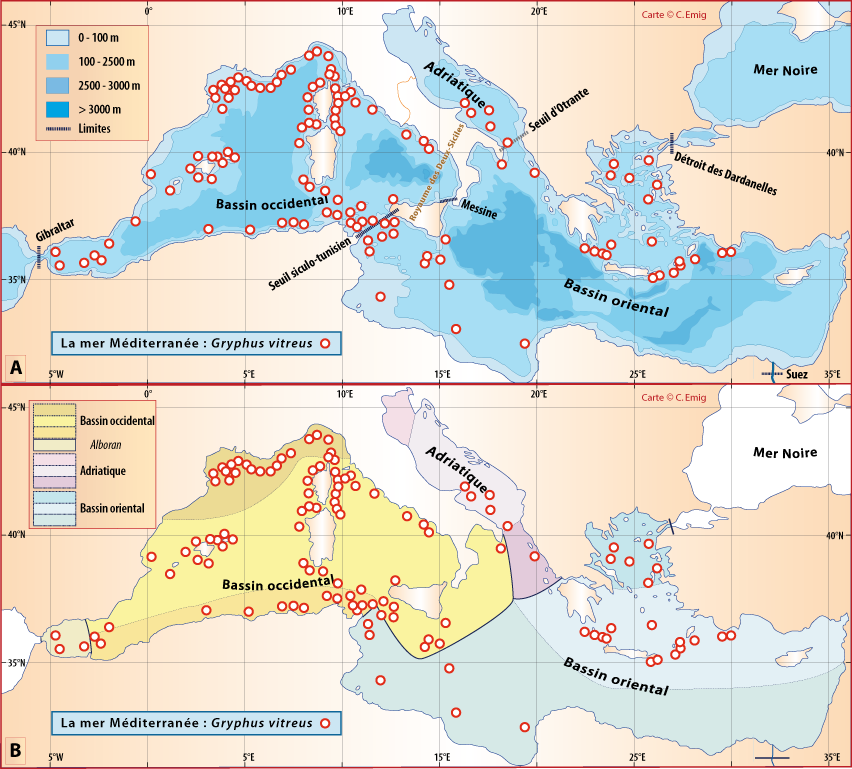
Figure 5-4 : Répartition de Gryphus vitreus en mer Méditerranée. A. et B. voir Fig 5-3 pour la légende des fonds de cartes.
Gryphus vitreus est aujourd’hui la plus grande des espèces de brachiopodes vivantes en mer Méditerranée. Les variations de la coquille et de ses caractères taxinomiques internes, au sein des milliers d’exemplaires récoltés, ont surpris les paléontologues de la RCP 727, notamment Bernard Laurin et Jean-Henri Delance (Université de Dijon, France) : c'est en juxtaposant des individus de taille similaire, dont la coquille varie depuis une forme ronde jusqu’à une pentagonale, que ces chercheurs en sont arrivés à une ligne formée par une centaine d’exemplaires. En l’absence d’une telle comparaison, des paléontologues auraient pu créer au moins trois espèces de Gryphus sur de simples variations des caractères, dont certains ne sont en rien taxinomiques, et encore moins phylogénétiques.
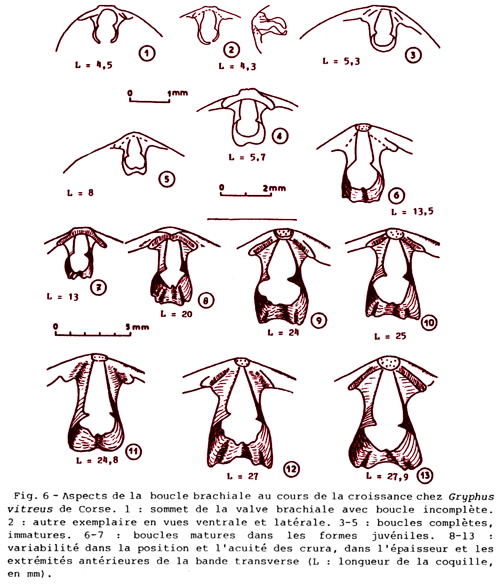
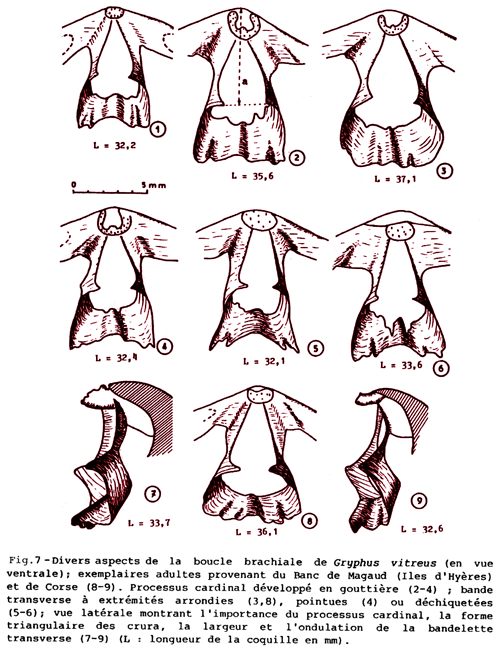
En plus de ces variations de la forme de la coquille s’ajoute un éventail complet des variations d’autres caractères, notamment du brachidium, au sein des populations de G. vitreus : elles sont illustrées sur la Fig. 5-5 (Boullier et al., 1986 ; Álvarez & Brunton, 2008). Ces résultats sont à comparer avec la variabilité établie chez le synonyme G. minor par Saccà (1985) qui n’évoque à aucun moment une comparaison avec G. vitreus. Il apparaît donc clairement que décrire une nouvelle espèce ou même un nouveau genre en ne disposant que de quelques individus peut rapidement conduire à prendre une variations pour un critères discriminant par rapport à une autre espèce, voire un genre. La littérature sur les espèces actuelles et fossiles de brachiopodes regorge d’exemples ; par exemple : - dans l’Antarctique, ces espèces représentent environ 30% (Emig, 2017b) ; - dans le Mésozoïque en France, 16 espèces de « Lingula » ont été décrites alors que l’on peut estimer à seulement une, voire deux espèces valides dans ce stock ; - le cas du genre Tichosina avec dix-neuf d’espèces décrites par Cooper (1977), la plupart récoltées au cours de la même campagne en mer dans la mer des Caraïbes (Rojas et al., 2015).
|
Figure 5-5 : Forme et variations du brachidium de Gryphus vitreus (en fac-similé de Boullier et al., 1986). |
|
G. vitreus est la seule à vivre sur un substrat meuble formé par un sable détritique, assez bien classé, contenant une forte proportion de petits substrats durs (surtout coquilliers) sur lesquels Gryphus s’attache par son pédoncule. Elle est une des espèces caractéristiques dans la biocœnose des Sables Détritiques Bathyaux (SDB) (Fig. 4-1, 4-2, 4-3 ; Pl. 2) dans l’étage bathyal supérieur. Le biotope est caractérisé par un hydrodynamisme constant d'intensité moyenne s'atténuant en profondeur, par de faibles variations annuelles de température et de salinité (Fig. 4-2). Cette biocœnose s’étend sous forme de ceinture horizontale dans la partie supérieure de la pente continentale ; cette extension dépend de deux facteurs principaux : la morphologie de la pente et la direction des courants sur cette pente (Fig. 4-1, 4-3). Les conséquences sur la distribution de G. vitreus peuvent se résumer en deux points :
- plus la pente est faible, moins les courants sont importants et moins forte l’extension bathymétrique en profondeur.
- plus la pente est forte, plus les courants sont forts, et plus l’extension en profondeur est grande, (jusqu’à 300 m au large du Cap Corse).
G. vitreus est aussi présente, mais peu abondante, avec les autres espèces de brachiopodes, dans la biocoenose bathyale des Coraux blancs profonds (aussi nommée « community of Cold-Water Coral ») (Pérès, 1982, 1985 ; Taviani et al., 2017).
L’infestation des coquilles de Gryphus par l’algue chlorophycée Ostreobium a conduit à revoir et redéfinir la limite inférieure du système phytal en mer Méditerranée (voir chapitre 6.)
Dans les années 1985, le Cap Corse et la Balagne (N et NW de la Corse) ont été ravagés par des feux de forêts, ce qui a entraîné les années suivantes de fortes décharges sédimentaires provoquant un envasement partiel du Bathyal supérieur. La zone affectée avait été prospectée avant et après ces événements (Emig, 1985a, 1989b, 1989c, 1990) : les effets analysés ont permis de modéliser une possible fossilisation par envasement pour mieux appréhender de futures interprétations paléontologiques de gisements de brachiopodes.
Des travaux sur la prédation de G. vitreus ont concerné les actions de gastéropodes naticidés, ce qui a permis de remettre en cause certains concepts pour les gisements fossiles (Delance & Emig, 2004). D’autres expériences ont montré que G. vitreus pouvait être une proie pour des langoustes (Emig, 1990). En effet, la langouste bathyale, dite du large, Palinurus mauritanicus Gruvel, 1911 [11], vit dans la même biocœnose, qui est une zone de pêche par casiers en Provence et par filets emmêlants en Corse. Elles fragmentent avec leurs mandibules broyeuses les deux tiers antérieurs de la coquille qu’elles tiennent avec leurs maxillipèdes, avant de manger du contenu de la coquille. Ce procédé pourrait en partie expliquer la présence de tels fragments dans les sédiments.
Un dernier point à ne pas négliger : selon la morphologie, le Bathyal est aussi zone de pêche par chalutage [12], ce qui perturbe à la fois la distribution et la densité de cette espèce, il faut en tenir compte dans les résultats (Emig & García-Carrascosa, 1991). Dans notre zone d’étude, ceci est le cas dans le Golfe du Lion et très rarement sur les côtes provençales ; c’est évidemment la morphologie de la pente qui conditionne la possibilité de chaluter. En outre, le rejet des refus de chalutage peuvent se produire au-delà des zones de récolte ce qui peut amener à des signalisations de brachiopodes hors de leur biotope naturel, donc à des profondeurs inhabituelles ce que les auteurs de telles signalisations ne prennent jamais en compte.
Sous-phylum Rhynchonelliformea
Classe Rhynchonellata
Ordre Terebratulida
Sous-ordre Terebratulidina
Super-famille Cancellothyridoidea
Famille Cancellothyrididae
Sous-famille Cancellothyridinae
Terebratulina d'Orbigny, 1847
Terebratulina retusa (Linné, 1758) [Anomia retusa Linné, 1758]
Synonymes : Anomia caputserpentis Linné, 1758 (voir Linné, 1767 et Emig et al., 2015) ; Terebratula caputserpentis : Retzius (1781) ; Criopoderma caput serpentis : Poli (1795) ; Terebratulina caput-serpentis : d’Orbigny (1847) ; Terebratula emarginata Risso, 1826 : Dall (1920) ; T. quadrata Risso, 1826 ; T. caput-serpentis Philippi, 1830 ; T. chemnitzii Küster, 1830 ; T. caputserpentis var. mediterranea Jeffreys, 1878 ; voir aussi Álvarez et al. (2005, p. 220), Emig (2012, 2017a, 2018), Emig et al. (2018).
Localité-type : Linné (1767) mentionne p. 1151 : « Habitat en pelago Norvegico » et p. 1153 pour caput-serpentis : « Habitat en abysso M. Norvegici »
Distribution : Fig. 4-5, 5-6 ; voir chapitres 8 et 9.
Terebratulina retusa vit attachée sur des substrats rocheux souvent concretionnés, ou des coquilles, des coraux morts… ; elle est fréquemment accompagnée par les autres brachiopodes cités ici, et notamment par Megathiris detruncata : dans 43 stations sur 46, pour un total de 1129 individus de T. retusa et de 639 de M. detruncata (voir chapitre 8). Elle est aussi présente, souvent très abondante, avec les autres espèces de brachiopodes, dans la biocoenose bathyale des Coraux blancs profonds (aussi nommée « community of Cold-Water Corals »). Sur des branches mortes de Madrepora et de Lophelia, Taviani et al. (2017) mentionnent une densité pouvant dépasser 450 individus pour 0,2 m2, avec Novocrania anomala, et quelques exemplaires de Gryphus vitreus et de Megerlia truncata, vers 400 m de profondeur.
Sa coquille à deux couches, outre le périostracum, se désagrège en quelques mois dans le milieu naturel (Collins, 1986 ; Emig, 1990), ce qui explique une relative rareté dans la signalisation de fossiles pour T. retusa.
Entre les populations atlantiques et méditerranéennes de T. retusa, les analyses moléculaires et morphométriques montrent de faibles variations et divergence génétique (Cohen et al., 1993), confirmant que ces populations appartiennent bien à une même espèce. Mais quant ces auteurs déduisent que les populations méditerranéennes qu’ils ont étudié (des côtes de Provence) dateraient d’environ 10 000 ans, mais sans faire allusion à la présence de cette espèce en Méditerranée depuis le Miocène, voire auparavant.
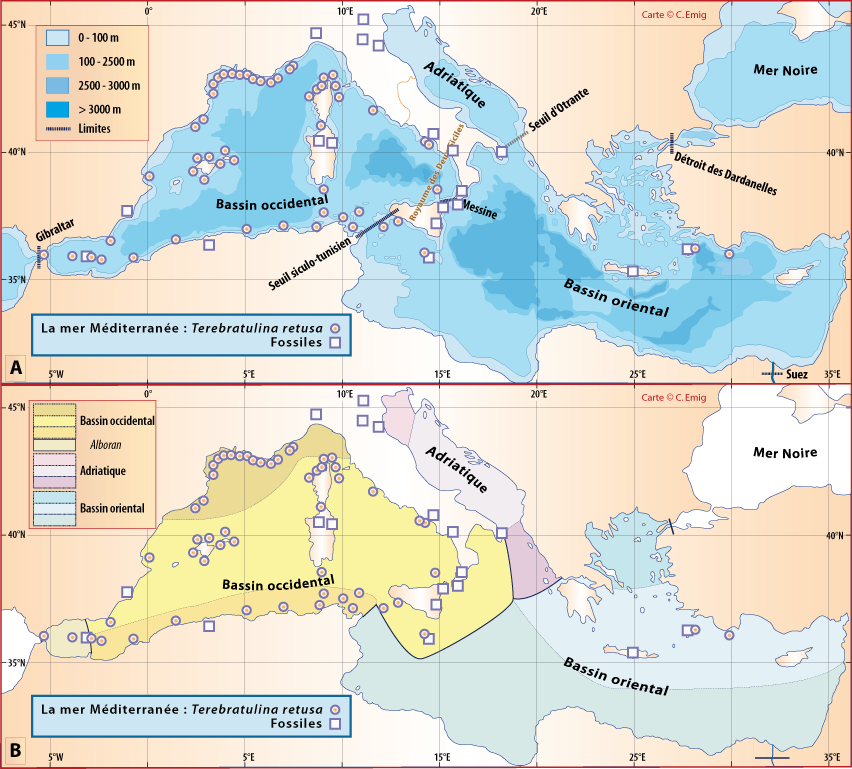
Figure 5-6 : Répartition de Terebratulina retusa en mer Méditerranée, ainsi que les signalisations de formes fossiles. A. et B. voir Fig 5-3 pour la légende des fonds de cartes.
Sous-phylum Rhynchonelliformea
Classe Rhynchonellata
Ordre Terebratulida
Sous-ordre Terebratellidina
Super-famille Megathyridoidea
Famille Megathyrididae
Megathiris d'Orbigny, 1847
Synonymes : Argiope Eudes-Deslongchamps, 1842 ; Megathyris Bronn, 1848 ; Argyope Davidson, 1850 ; voir aussi Emig (2018), Emig et al. (2018).
Megathiris detruncata (Gmelin, 1791) [Anomia detruncataGmelin, 1791]
Synonymes : Anomia decollata Chemnitz, 1785 ; Terebratula aperta Blainville, 1828 ; Terebratula dimidiata Scacchi, 1833
Localité-type : « Habitat in mari mediterraneo, coralliis adhaerens » d’après Gmelin (1791). Connue depuis l’Eocène.
Distribution : Fig. 4-5, 5-7, Pl. 2 ; voir chapitres 8 et 9.
Megathiris detruncata est une petite espèce souvent cryptique, vivant dans des concretionnements sur substrats rocheux, principalement dans le Circalittoral et le Bathyal ou dans les grottes sous-marines. Elle se fixe sur des coraux morts (Pl. 2). Elle est généralement accompagnée par une ou plusieurs autres espèces de brachiopodes, notamment Terebratulina retusa.
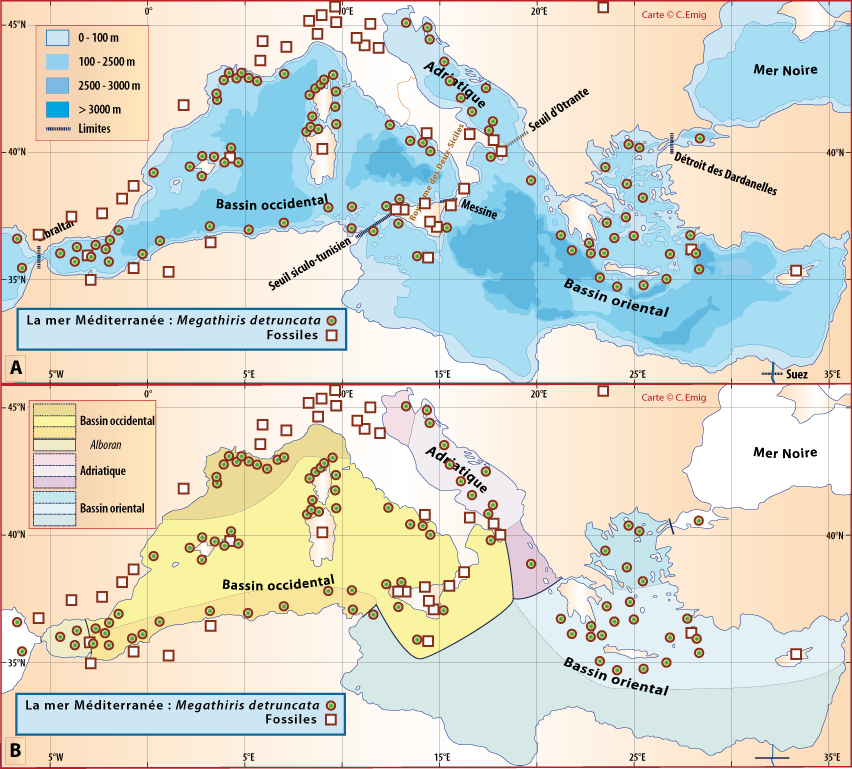
Figure 5-7 : Répartition de Megathiris detruncata en mer Méditerranée, ainsi que les signalisations de formes fossiles. A. et B. voir Fig 5-3 pour la légende des fonds de cartes.
Sous-phylum Rhynchonelliformea
Classe Rhynchonellata
Ordre Terebratulida
Sous-ordre Terebratellidina
Super-famille Platidioidea
Famille Platidiidae
Sous-famille Platidiinae
Platidia Costa, 1852
Synonymes : Morrisia Davidson, 1852 ; Platydia : Seguenza (1870) ; voir aussi Álvarez et al. (2005, p. 222), Emig (2018), Emig et al. (2018).
Platidia anomioides (Scacchi et Philippi, 1844, in Philippi, 1844) [Orthis anomioides Scacchi et Philippi, 1844, in Philippi, 1844]
Synonymes : Terebratula appressa Forbes, 1843 ; Morrisia anomioides : Davidson (1852, 1869) ; Morrisia davidsoni Eudes-Deslongchamps, 1855 ; Platidia davidsoni Dall, 1870 ; Platydia anomioides : Jeffreys (1878) ; Platydia davidsoni : Davidson (1887).
Localité-type : eaux marines siciliennes. Connue depuis le Miocène. La localité-type de P. davidsoni est au large de Tunis (Tunisie), espèce décrite par Eudes-Deslongchamps (1855, p. 443).
Distribution : Fig. 5-8 ; voir chapitres 8 et 9.
Platidia anomioides n’a été récoltée qu’exceptionnellement dans 13 stations. P. davidsoni est considérée comme synonyme de P. anomioides : les deux espèces cohabitaient notamment en mer Méditerranée et leur aspect externe est identique. Certains auteurs n’ont utilisé que la largeur de la coquille légèrement plus grande pour P. davidsoni et la présence de nombreuses petites pustules sur la valve ventrale d’après des caractères suggérés par Cooper (1973), Brunton & Curry (1979), pour distinguer ces espèces. Or, Logan (1979), rejetant les arguments de Cooper, ne trouve qu’un seul critère pouvant distinguer les deux espèces, à savoir que le support brachial à un stade plus avancé de développement chez P. anomioides que chez P. davidsoni ; ceci a déjà été souligné par Davidson (1886) en mentionnant la similitude des deux espèces. Aussi, en l’absence d’une étude sur les variations de ce support et de son caractère phylogénétique indéniable, prouvant qu’un stade de développement du brachidium peut être un caractère taxinomique constant, P. davidsoni est traité comme synonyme de P. anomioides. Logan (1979) précise : « As P. davidsoni represents merely a less advanced state of development of the brachial support than in adult P. anomioides, no new genus has been created for its reception at the present time. » Enfin, beaucoup de localisations sont sujettes à caution, car les auteurs ont attribué leurs exemplaires à l’une ou l’autres des espèces en fonction d’observations subjectives. Ce cas Platidia est similaire à celui de Novocrania anomala (voir Emig, 2014 ; et Appendices A et C).
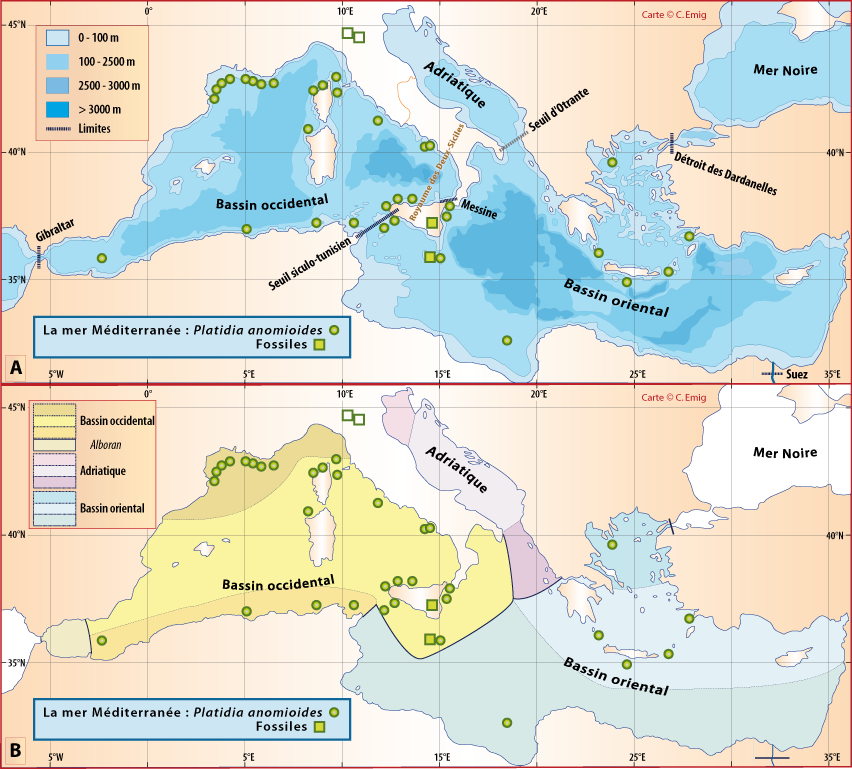
Figure 5-8 : Répartition de Platidia anomioides en mer Méditerranée, ainsi que les signalisations de formes fossiles. A. et B. voir Fig 5-3 pour la légende des fonds de cartes.
En outre, l’historique de Terebratula seminulum Philippi, 1836 est développé dans l’Appendice C. Car, selon certains auteurs, elle serait synonyme de Platidia anomioides ou/et de Joania cordata, alors que des travaux récents la rangent dans le genre Amphithyris, inconnu en mer Méditerranée et avec une distribution restreinte au sud de l’Hémisphère Sud. La localité type de T. seminulum est Trapani en Sicile (Italie).
Sous-phylum Rhynchonelliformea
Classe Rhynchonellata
Ordre Terebratulida
Sous-ordre Terebratellidina
Super-famille Kraussinoidea
Famille Kraussinidae
Sous-famille Megerliinae
Megerlia King, 1850
Synonymes : Mühlfeldtia Bayle, 1880 ; Megerlia Filhol, 1885 ; Megerlia Brazier, 1889 ; Pantellaria Dall, 1919 ; voir aussi Emig (2018), Emig et al. (2018).
Megerlia truncata (Linné, 1767) [Anomia truncata Linné, 1767]
Synonymes : Terebratula truncata : Retzius (1781) ; Criopoderma truncatum : Poli (1795) ; Mühlfeldtia truncata : Fischer et Œhlert (1891) ; Mühlfeldtia disculus : Dall (1920) (non Pallas 1766).
Terebratula monstruosa Scacchi, 1833 ; Megerlia truncata var. monstruosa : Montecristo (1875) ; Mühlfeldtia monstruosa Fischer et Œhlert, 1891 ; Pantellaria monstruosa : Dall (1920).
Morrisia gigantea Deshayes, 1863.
Megerlia echinata (Fischer et Œhlert, 1890).
Localité-type : « Habitat in Pelago Norvegico supra corallin ». Connue depuis le Miocène.
Distribution : Fig. 5-9, Pl. 2 ; et voir chapitres 8 et 9.
Megerlia truncata est surtout fixée sur des substrats relativement plats et verticaux, notamment sur les branches mortes du scléractiniaire Dendrophyllia cornifera sur lesquelles elle peut atteindre des densités de 10-20 individus par branche (Pl. 2). Il s’agit aussi bien de thanatocoenoses que d’espèces encores vivantes alimentant ces fonds particuliers. M. truncata est aussi présente sur des substrats rocheux plats en même temps de Novocrania anomala. Ces deux espèces cohabitent dans 41 stations sur 47 : 30 stations en Corse avec un ratio de présence de 69% (765 individus) pour Megerlia et seulement 31% pour Novocrania (243 individus) ; 11 stations en Provence avec respectivement 73% (267 ind.) et 27% (37 ind.).
Dans l’étage Bathyal, M. truncata vit dans la biocœnose des Sables Détritiques Bathyaux, dans la bioœnose des Coraux blancs Profonds, notamment sur les coraux Lophelia et Madrepora ; cette dernière biocœnose est aussi nommé « community of Cold-Water Corals » (Pérès, 1982, 1985 ; Taviani et al., 2017). Pour le Circalittoral, voir la fig. 5-7 et aussi dans des grottes sous-marines semi-obscures, parfois à faible profondeur.
Comme l’avait noté Thomson (1927), Megerlia truncata peut être très variable dans la forme de sa coquille et de l’adapter en fonction de son environnement. Cette caractéristique avait entraîné la description de plusieurs espèces et variétés, qui ont longtemps fait débat : M. monstruosa (même avec la création du genre Pantellaria), M. echinita et M. gigantea (voir Bitner & Logan, 2016 ; Álvarez et al., 2017 ; Emig et al., 2018). Le matériel décrit sous M. gigantea est déposé au Muséum National d’Histoire naturelle de Paris : il a été étudié et comparé aux exemplaires méditerranéens de M. truncata. Deshayes (1863) a décrit Morrisia gigantea comme « L'espèce de Bourbon est la plus grande connue du genre. » à partir d’un seul exemplaire récolté sur un crustacé à 366 m de profondeur (200 brasses).
La prédation par des gastéropodes perforants a été étudiée chez des Megerlia fossiles dans le Pliocène en Algérie (Baumiller et al., 2006) ; or, celle-ci est extrêmement rare d’après les prélèvements effectués au cours des campagnes citées dans ce travail.
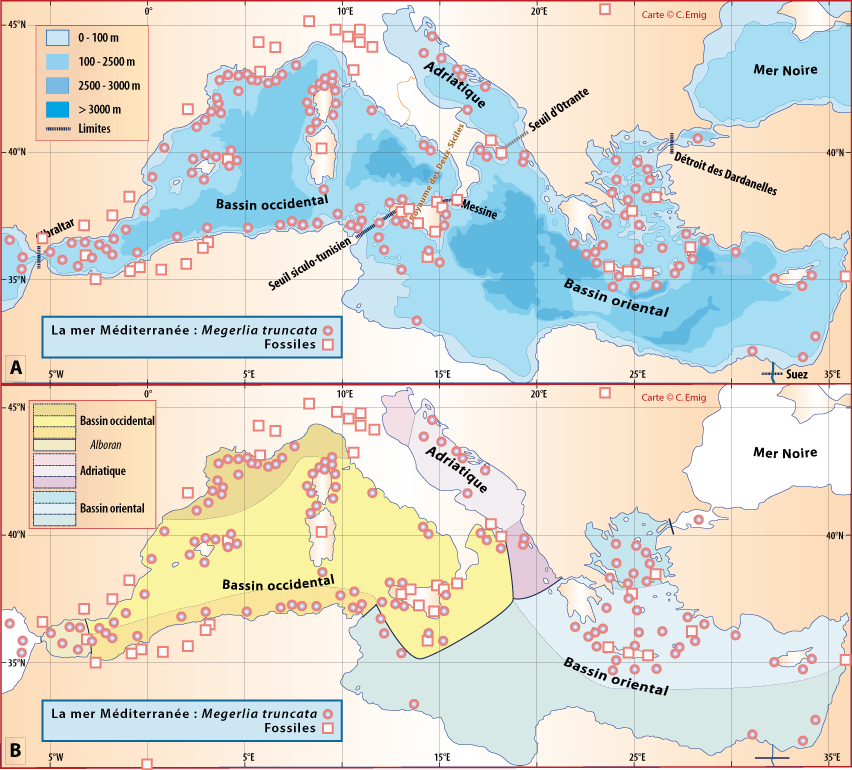
Figure 5-9 : Répartition de Megerlia truncata en mer Méditerranée, ainsi que les signalisations de formes fossiles. A. et B. voir Fig 5-3 pour la légende des fonds de cartes.
[5] Aujourd’hui nommé Observatoire Océanologique de Banyuls-sur-Mer. Ce laboratoire a été fondé en 1881 par Henri de Lacaze-Duthiers (1821-1901), professeur à l’Université de Paris.
[6] Aujourd’hui, les locaux se partagent entre l’Institut Méditerranéen de Biodiversité et d'Ecologie marine et continental (IMBE) et l’Institut Méditerranéen d’Océanologie (MIO). Elle a été fondée en 1889 par Antoine-Fortuné Marion (1846-1900), professeur à l’Université d’Aix-Marseille, sur le site à Malmousque, un petit quartier de Marseille, face à la mer.
[7] Aujourd’hui nommée Observatoire Océanologique de Villefranche-sur-mer. Créé en 1884 par Alexis de Korotneff (1852-1915), professeur à l’Université de Kiev, dans les anciens locaux de la base navale russe. Ce n’est qu’en 1932 que les locaux sont cédés à la France et mis à la disposition dFe l’Université de Paris.
[8] Ce musée fut fondé en 1889 par le Prince Albert Ier de Monaco (1848-1922) – de nombreux brachiopodes furent récoltés et décrits au cours de ses campagnes en mer Méditerranée et dans l’océan Atlantique. Il appartient à la Fondation Albert Ier, Prince de Monaco (fondation de droit français).
[9] Le submersible utilisé pour les trois plongées avait l’Arsenal de Toulon (Marine nationale) comme port d’attache, créé en 1609 par le roi de France Henri IV. La Mission Océanographique de Méditerranée qui y est installée m’a été d’une grande aide dans l’exploitation de la bathymétrie des stations de mes campagnes par la mise à disposition de cartes marines très précises permettant d’obtenir des profils détaillés des radiales.
[10] Extrait du Code International de Nomenclature Zoologique (ICZN, 1999)
- Recommandation 13A. Présentation des éléments de différenciation. Lorsqu'il décrit un nouveau taxon nominal, un auteur devrait indiquer clairement les éléments de différenciation de ce taxon. en donnant une diagnose, c'est-à-dire un résumé des caractères qui différencient ce taxon nominal des taxons comparables.
Diagnose, s. f., Énoncé écrit établissant l'ensemble des caractères d'un taxon qui suffisent à le distinguer des autres taxons auxquels il peut être utilement comparé.
Recommendation 13A. Intent to differentiate. When describing a new nominal taxon, an author should make clear his or her purpose to differentiate the taxon by including with it a diagnosis, that is to say, a summary of the characters that differentiate the new nominal taxon from related or similar taxa.
Diagnosis, n. A statement in words that purports to give those characters which differentiate the taxon from other taxa with which it is likely to be confused.
[11] Rarement la langouste rouge ou commune Palinurus elephas (Fabricius, 1787), vivant sur le plateau continental, avec une extension possible au-delà du rebord jusque vers 150 m, voire au-delà. Cette espèce est une espèce emblématique de l’océan Nord Atlantique et de la Méditerranée ; c’est la plus chère des langoustes.
[12] Depuis juin 2017, l’Union Européenne interdit le chalutage à plus de 800 m de profondeur dans ses eaux.

Planche 2 : A-B : branches du scléractiniaire Dendrophyllia cornigera, avec de nombreux brachiopodes (Novocrania anomala, Megerlia truncata, Platidia anomioides), st. BM 30 (Corse), A 36, A 91 (Provence). C : Megerlia fixée sur Novocrania. D : Fond rocheux (-255 m) au large de l'Île de Porquerolles (Provence, France), avec Novocrania anomala, Megathiris detrunctata et de nombreuses Megerlia truncata, dont certaines présentent la forme monstruosa avec déformation de la coquille en fonction du substrat. E : Thanatocœnose würmienne à Venus casina Linné, 1758, vers 230 m de profondeur avec Gryphus vitreus (plongée en submersible au Banc du Magaud, BraProv 2 ; Emig, 1987). F : Extrait d’enregistrement vidéo au cours de la plongée en submersible au large de l’ile de Porquerolles, BraProv 10 ; Emig & & García-Carrascosa, 1991). © Clichés C.C. Emig. G : Gryphus photographié par un ROV à 470 m de profondeur dans le canyon du Cap Sicié (près de Toulon) lors de la campagne MedSeaCan (Goujard & Fourt, 2012). © Cliché Agence des aires marines protégées.

Nota : De nombreuses photographies de diverses espèces de brachiopodes sont en ligne à http://paleopolis.rediris.es/LOPH-Album/
6. Distribution d’Ostreobium dans les coquilles de Gryphus
La première signalisation de l’algue verte unicellulaire perforante Ostreobium quekettii Bornet et Flahaut, 1889 dans la coquille de Gryphus vitreus, une espèce strictement bathyale, été faite en mer Méditerranée par Fredj & Falconetti (1977), puis étudiée par Fredj-Reygrobellet & Fredj (1982). O. quekettii, considérée comme une espèce cosmopolite, est perforante dans des coquilles de mollusques et de brachiopodes ; elle se reproduit par des zoospores à quatre flagelles (voir Kornmann &. Sahling, 1980 ; Cormaci et al., 2014).
Les coquilles de Gryphus vitreus ne sont révélées être rarement infestées le long des côtes continentales françaises (Emig, 1989c), à l’exception d’individus provenant des environs des Îles d’Hyères. Plus à l’ouest de ces îles, les eaux sont relativement turbides, avec une pénétration de la lumière fortement réduite en liaison avec le courant ligure qui est la composante nord du courant anticyclonique circulant dans le bassin occidental de la mer Méditerranée. Ce courant ligure draine d’Est à l’Ouest, le long des côtes, les importants rejets en mer des villes et des fleuves d’Italie et de France et ensuite vers les côtes espagnoles.
En revanche, la limpidité des eaux est meilleure en Corse où des nombreux Gryphus infestés ont été récoltés dans de très nombreuses stations de dragages et de chalutages, notamment le NW et NE de la Corse et au Nord du Cap Corse (Fig. 6-1) (Emig, 1985a, 1989a) : huit radiales ont été choisies, représentant les différents profils géomorphologiques et zones de densités de G. vitreus (Fig. 4-1, 4-3) ; les comptages de Gryphus ont été faits en se basant sur la couleur des coquilles : blanche estimée sans infestation, verdâtre à vert avec Ostreobium. Les données brutes sont indiquées dans le chapitre 8.
Les résultats en Gryphus verts (Fig. 6-1) sont brièvement commentés. Globalement, les pourcentages sont faibles à nul dans la zone 1 (Fig. 4-3), ce qui peut être expliqué par l’effet de seuil qui se manifeste au niveau du rebord du plateau continental avec un hydrodynamisme particulier, pouvant être notoirement vertical sur plusieurs mètres, voire une dizaine de mètres. C’est dans les zones 2 et 3 que s’observent les plus forts pourcentages, jusque vers une profondeur d’environ 150 à 200 m, et jusqu’à plus de 300 m au Nord du cap Corse. Plusieurs radiales (Fig. 6-1) demandent quelques explications complémentaires, incluant des similitudes entre les radiales C4, C5 et C8 quant aux conséquences d’envasement, ce qui peut être un cas de taphonomie (Emig, 1989c, 2002).
- Radiale C6N. L’extension en profondeur des Gryphus verts est la plus importante, jusqu’à 310-315 m, car le plateau continental au Nord du Cap Corse est soumis à un fort hydrodynamisme, avec une faible turbidité en profondeur, liée à son éloignement des côtes.
- Radiale C4. Suite à de nombreux feux de forêts dans l’arrière–pays en Balagne (Emig, 1989c), il s’est produit un envasement du plateau et du rebord de la pente continentale, jusque vers 135 m de profondeur, avec une influence s'étendant sur tout le plateau « offshore» jusque vers 150 m. Cela a induit une baisse sensible de la densité des individus vivants de G. vitreus et une diminution nette des coquilles de G. vitreus infestées par des Ostreobium, comme pour la radiale C 5.
- Radiale C5. Entre 1985 et 1987, Emig (1989c, 1990) mentionne une importante mortalité de G. vitreus, avec forte baisse de la densité jusque vers 170-180 m de profondeur ; au-delà, on retrouve une densité normale de G. vitreus (environ 250-300 individus par dragage). La présence de coquilles infestées par l’Ostreobium est limitée à 130-135 m. Cette radiale est située à proximité d’un canyon sous-marin. L'origine de l'envasement pourrait être liée à de fortes décharges terrigènes par suite de la brutale déforestation par le feu des massifs montagneux côtiers environnants.
- Radiale C8. L'envasement de la radiale C8 provient probablement de la proximité de l'embouchure du fleuve Le Golo avec des décharges alluvionnaires, ainsi que des « graus » de l'étang de Biguglia (Emig, 1989c). Sa densité en Gryphus est faible avec un peu de coquilles infestées par Ostreobium.
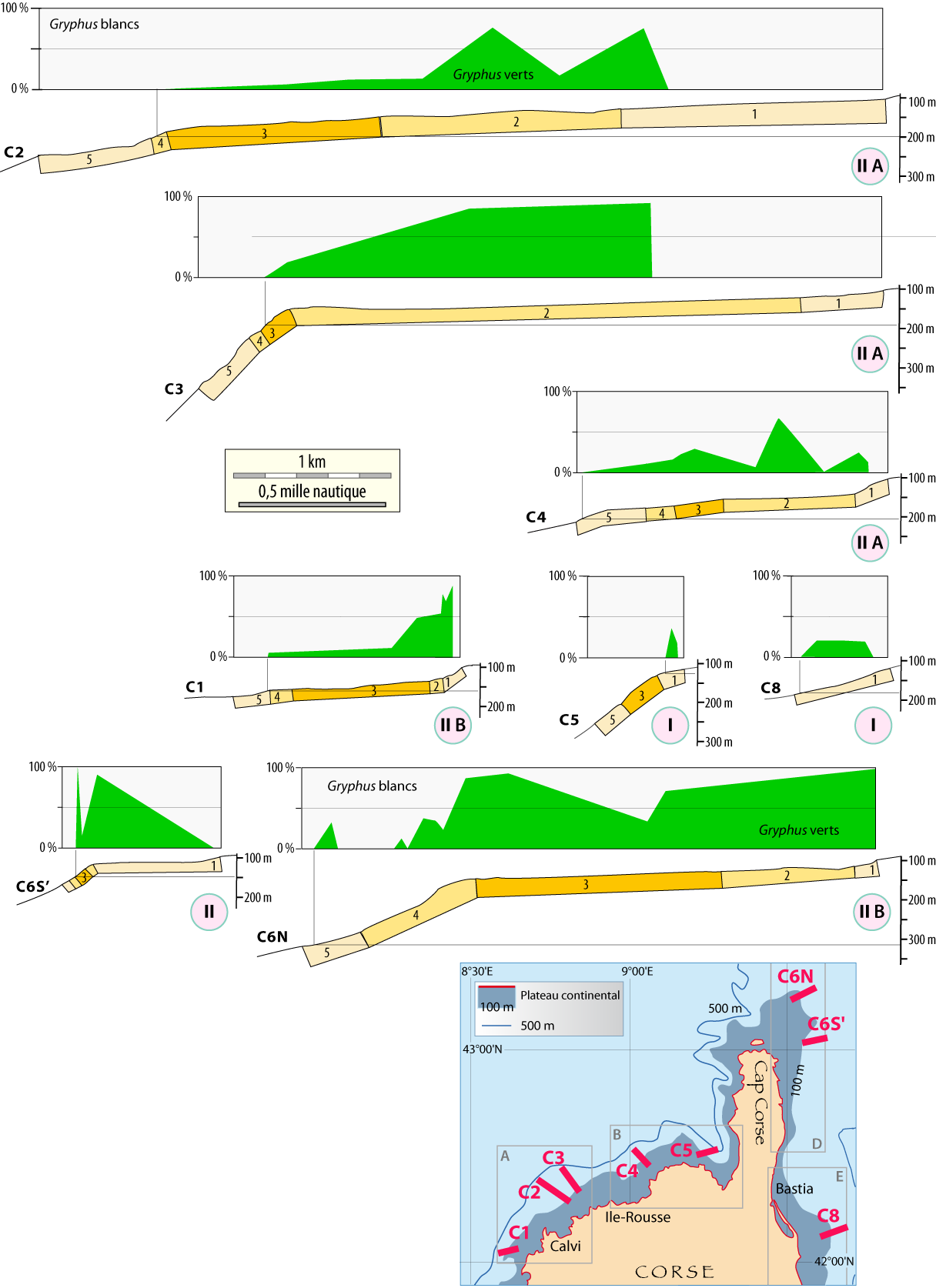
Figure 6-1 : Localisation des radiales avec les pourcentages de Gryphus « verts » le long du profil de chaque radiale avec les densités de Gryphus (voir explication Fig. 4-3).
7. La limite du système phytal : Gryphus comme marqueur
La limite biologique entre le système phytal et aphytal [13], définie par la flore et la faune benthique, fut un débat au cours du siècle dernier, qui n’a guère évolué depuis. En résumé, selon Pérès & Picard (1964) : « l’ensemble des quatre étages… constitue le système littoral, ou encore puisqu’il est caractérisé par la présence de végétaux benthiques chlorophylliens, le système phytal. » Pérès (1982) mentionne : « In the phytal system four vertical zones may be distinguished. Their names always include the suffix “littoral” » et que l’étage le plus profond dans le système phytal, nommé Circalittoral, a comme limite inférieure « down to the maximal depth consistent with the survival of photoautotrophic multicellular algae. »
Une zone intermédiaire entre le Circalittoral et le Bathyal avec la présence d’algues unicellulaires avait été créée et nommée Bathylittoral par Ercegovic (1957), un terme repris par Pérès & Picard (1964). Puis, Pérès (1982) intègre cette zone dans le Circalittoral, tout en la considérant comme une transition et en précisant « a true bathylittoral zone with specific organismic assemblages does not exist. » Bien des auteurs ont continué à se conformer à cette vision, comme Falconetti (1980), Bellan-Santini (1983), Bellan-Santini et al. (1994), Pergent et al. (2007), Dauvin (comm. pers.), et se retrouve dans divers dictionnaires biologiques, comme le glossaire Ifremer (voir http://envlit.ifremer.fr/infos/glossaire/e/etages_benthiques), l’étage Bathyal étant lui considéré comme faisant partie du système aphytal.
Ce n’est qu’avec les nombreuses campagnes en mer faites dans le cadre du programme RCP-CNRS 728 (1983-1989), avec une approche multidisciplinaire, que la position de cette zone dite intermédiaire a été définie comme étant le Bathyal supérieur (Emig, 1989a, 1889b, 1997a ; Laubier & Emig, 1993 ; Emig & Geistdoerfer, 2004). En conséquence, la limite du système phytal s’avère indépendante de l’étagement, de la bathymétrie et de la distribution des seuls organismes pluricellulaires photosynthétiques benthiques.
En fait, la limite au niveau du rebord du plateau continental entre le Circalittoral et le Bathyal n’est pas liée à l’éclairement, mais à un changement de facteurs (donc de biotope dans le cas présent), parmi lesquels l’éclairement ne peut être retenu, ni utilisé comme facteur discriminant. Cette limite marque (ou n’est que) le passage du domaine littoral au domaine profond (Emig, 1997a), pas entre le système phytal et aphytal. Car la limite entre ces deux systèmes est fonction de la turbidité des eaux.
Les résultats sur la présence de l’algue verte unicellulaire Ostreobium dans les coquilles de Gryphus (voir chapitre 6, ci-dessus) a permis de reprendre le débat sur la limite du système phytal en confirmant nos propos ci-dessus : la distribution des coquilles avec Ostreobium est bien liée à la pénétration en profondeur. Pratiquement absentes sur les côtes provençales à cause de la turbidité des eaux, ces coquilles sont présentes en Corse jusque vers 150-200, voire 300 m (Fig. 6-1).
Il est généralement admis que la limite inférieure du système phytal correspond à une irradiance de 1%. La mesure de cette limite ne peut se faire que par l’extension de microalgues ou algues unicellulaires photosynthétiques (Tett, 1990) ; le cas d’Ostreobium est un bon exemple permettant d’utiliser une espèce benthique. Si on lit souvent que cette limite se situe vers 200 m, il faut rappeler que sa profondeur n’est valable qu’au seul lieu de la mesure, en attestent ses variations bathymétriques en Corse (Fig. 6-1).
8. Cahiers des stations
Liste des cahiers de stations et des récoltes de brachiopodes : Tableaux 3 à 10.
| Provence | chapitre 8 : stations | chapitre 9 : cartes |
| BraProv 0-10 | Tableau 3 et Tableau 4 | Figures 9-2, 9-3 |
| IsoBra et DEPROG | Tableau 5 | Figures 9-1, 9-2 |
| Corse | ||
| BraCors 1-6 | Tableau 6 et Tableau 7 | Figures 9-4, 9-5, 9-6, 9-7, 9-8 |
| BathyMed | Tableau 8 et Tableau 9 | Figures 9-4, 9-5, 9-6 |
| Meditis 2-4 | Tableau 10 | Figures 9-4, 9-7 |
?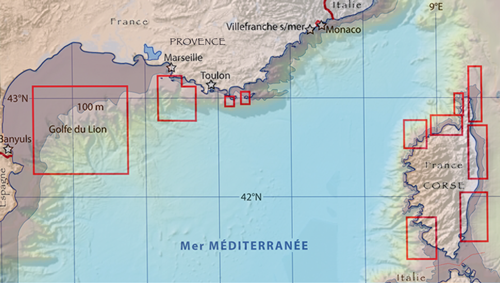
Tableau 3 : Campagnes BraProv (CNRS ; chef de mission : Christian C. Emig). Figures 9-2 et 9-3.
[Légende en fin de tableau]
| Campagnes et Stations |
Zone |
Prof [D - F]
|
Cap
|
Distance
|
Latitude N [D]
|
Longitude E [D]
|
Latitude N [F]
|
Longitude E [F]
|
Engins | Brachiopoda | ||
| 0 | A 1 | 0 | 70 | 43°07'36 | 5°32'12 | DF | B | |||||
| 0 | A 2 | 160 | 80 | 43°06'27 | 5°32'12 | DF | B | |||||
| 0 | A 3 | 0 | 43°07'24 | 5°33'30 | DF | B | ||||||
| 0 | A 4 | 145 | 0 | 43°07'03 | 5°33'42 | DF | B | |||||
| 0 | A 5 | 160 | 45 | 43°06’30 | 5°33'36 | DF | B | |||||
| 0 | A 6 | 250 | 220 | 45 | 43°06'42 | 5°30'12 | DF | B | ||||
| 1 | A 1 | 120 | ? | 0 | 43°07'27 | 5°33'24 | DF | |||||
| 1 | A 2 | 240 | 130 | 0 | 43°06'54 | 5°33'21 | DF- | B | ||||
| 1 | A 3 | 140 | 100 | 45 | 43°06'45 | 5°33'36 | DF | B | ||||
| 1 | A 4 | 240 | ? | 45 | 43°06'39 | 5°34'21 | DF | B | ||||
| 1 | A 5 | 250 | 240 | 90 | 43°03'18 | 5°30'18 | DF- | |||||
| 1 | A 6 | 250 | 280 | 90 | 43°03'18 | 5°30'18 | DF- | B | ||||
| 1 | A 7 | 250 | ? | 90 | 43°03'12 | 5°30'21 | DF- | |||||
| 1 | A 8 | B | 220 | 150 | 270 | 43°01'35 | 5°41'05 | DF- | ||||
| 1 | A 9 | B | 180 | ? | 270 | 43°01'00 | 5°41'10 | DF | B | |||
| 1 | A 10 | B | 220 | 140 | 270 | 43°01'20 | 5°41'20 | DF | ||||
| 1 | A 11 | B | 200 | ? | 270 | 43°00'20 | 5°40'10 | DF | B | |||
| 1 | A 12 | B | 210 | 230 | 0 | 42°58'10 | 5°41'10 | DF | ||||
| 1 | A 13 | B | 250 | 160 | 45° | 42°58'24 | 5°36'24 | DF | B | |||
| 1 | A 14 | B | 280 | 155 | 45 | 42°58'48 | 5°35'42 | DF | B | |||
| 1 | A 15 | B | 250 | 155 | 45 | 42°59'36 | 5°34'51 | DF | B | |||
| 2 | TG 16 | M | 345 | 70 | 43°01'57 | 6°38'45 | SUBM | B | ||||
| 3 | A 17 | B | 200 | 140 | 45 | 43°00'18 | 5°35'06 | DF- | B | |||
| 3 | A 18 | B | 200 | 160 | 60 | 42°58'30 | 5°36'30 | DF | B | |||
| 3 | A 19 | B | 160 | 180 | 340 | 42°58'51 | 5°35'51 | DF | B | |||
| 3 | A 20 | M | 110 | 105 | 250 | 43°02'21 | 6°38'24 | DF | B | |||
| 3 | A 21 | M | 120 | 110 | 250 | 43°02°06 | 6°38'09 | DF | ||||
| 3 | A 22 | M | 120 | 130 | 70 | 43°01'51 | 6°38'00 | DF | B | |||
| 3 | A 23 | M | 120 | ? | 250 | DF- | ||||||
| 3 | A 24 | M | 120 | 160 | 250 | 43°01'12 | 6°37'51 | DF | B | |||
| 3 | A 25 | M | 245 | 235 | 40 | 43°01'12 | 6°37'27 | DF- | B | |||
| 3 | A 26 | M | 245 | 210 | 240 | 43°00'48 | 6°36'06 | D- | B | |||
| 3 | A 27 | M | 200 | 120 | 43°02'09 | 6°38'36 | DF- | B | ||||
| 3 | A 28 | M | 380 | 420 | 43°02'00 | 6°39'24 | DF | |||||
| 3 | A 29 | M | 180 | 120 | 260 | 43°02'18 | 6°39'00 | DF | B | |||
| 3 | A 30 | PC | 220 | 160 | 260 | 43°58'18 | 6°23'00 | DF | B | |||
| 3 | A 31 | PC | 180 | 120 | 260 | 43°58'06 | 6°22'24 | DF | ||||
| 3 | A 32 | PC | 120 | 110 | 250 | 43°58'36 | 6°22'30 | DF | B | |||
| 3 | A 33 | PC | 330 | 360 | 220 | 43°57'48 | 6°20'24 | A- | ||||
| 3 | A 34 | B | 160 | 170 | 42°59'24 | 5°35'39 | DF | |||||
| 3 | A 35 | B | 180 | 260 | 130 | 42°58'42 | 5°36'09 | DF- | B | |||
| 3 | A 36 | B | 175 | 180 | 160 | 42°53'36 | 5°36'24 | DF | B | |||
| 3 | A 37 | B | 320 | 360 | 42°58'21 | 5°36'03 | D | |||||
| 3 | A 38 | B | 360 | 360 | 90 | 42°59'18 | 5°33'42 | D | ||||
| 3 | A 39 | B | 180 | 155 | 340 | 43°00'54 | 5°33'24 | DF | B | |||
| 4 | CL 40 | 110 | 140 | 43°40.64 | 7°18.71 | 43°41.15 | 7°18.90 | ROV | ||||
| 4 | CL 41 | 200 | 55 | 325 | 43°41.42 | 7°24.86 | 43°41.97 | 7°24.26 | ROV | |||
| 4 | CL 42 | 430 | 380 | 230 | 43°41.30 | 7°26.13 | 43°40.94 | 7°24.93 | ROV | |||
| 5 | A 44 | B | 140 | 140 | 340 | 43°01.35 | 5°33.65 | DF | ||||
| 5 | A 45 | B | 140 | 140 | 310 | 43°01.35 | 5°33.65 | DF | B | |||
| 5 | A 46 | B | 150 | 140 | 130 | 43°01.20 | 5°33.60 | DF | B | |||
| 5 | A 47 | B | 140 | 150 | 130 | 43°01.20 | 5°33.60 | D- | ||||
| 5 | A 48 | B | 130 | 125 | 330 | 43°01.85 | 5°34.30 | D | B | |||
| 5 | A 49 | B | 130 | 125 | 140 | 43°01.95 | 5°34.45 | L | B | |||
| 5 | A 50 | B | 140 | 140 | 330 | 43°02.00 | 5°33.50 | C | ||||
| 5 | A 51 | 140 | 170 | 310 | 43°05.80 | 5°33.75 | C- | |||||
| 5 | A 52 | B | 155 | 160 | 120 | 43°00.50 | 5°34.70 | C | B | |||
| 5 | A 53 | B | 160 | 165 | 320 | 43°00.50 | 5°34.60 | L | ||||
| 5 | A 54 | B | 160 | 160 | 330 | 43°00.70 | 5°34.20 | D | B | |||
| 5 | A 55 | B | 250 | 260 | 330 | 42°59.65 | 5°34.40 | D | B | |||
| 5 | A 56 | B | 220 | 260 | 290 | 43°00.25 | 5°33.30 | L | ||||
| 5 | A 57 | B | 240 | 230 | 290 | 42°59.90 | 5°33.90 | C- | B | |||
| 5 | A 58 | 240 | 280 | 340 | 43°06.05 | 5°31.60 | D- | |||||
| 6 | CL 59 | PC | 120 | 96 | 70 | 42°58.74 | 6°23.67 | 42°58.95 | 6°24.00 | DF | B | |
| 6 | CL 60 | PC | 170 | 140 | 260 | 42°58.62 | 6°23.64 | 42°58.62 | 6°23.26 | D- | B | |
| 6 | CL 61 | PC | 250 | 130 | 300 | 42°58.10 | 6°21.95 | 42°58.32 | 6°21.07 | DF | B | |
| 6 | CL 62 | PC | 150 | 160 | 85 | 42°58.30 | 6°21.24 | 42°58.28 | 6°21.74 | DF | B | |
| 6 | CL 61 | PC | 160 | 160 | 130 | 42°58.30 | 6°21.67 | 42°57.65 | 6°22.42 | L | ||
| 6 | CL 64 | PC | 1000 | 800 | 60 | 42°56.23 | 6°22.75 | 42°56.40 | 6°23.00 | D- | ||
| 6 | CL 65 | PC | 1000 | 800 | 60 | 42°56.42 | 6°22.93 | 42°56.59 | 6°23.42 | D- | ||
| 6 | CL 66 | P | 130 | 129 | 110 | 42°58'30 | 6°06'57 | 42°58.47 | 6°06.56 | DF | B | |
| 6 | CL 67 | P | 132 | 132 | 285 | 42°58'19 | 6°07'07 | 42°58.17 | 6°07.55 | DF | B | |
| 6 | CL 68 | P | 132 | 132 | 105 | 42°58'20 | 6°06'43 | 42°58.40 | 6°06.25 | L | ||
| 6 | CL 69 | P | 132 | 132 | 285 | 42°58'12 | 6°06'55 | 42°58.07 | 6°07.37 | D | ||
| 6 | CL 70 | P | 132 | 132 | 160 | 42°58'34 | 6°06'38 | 42°58.40 | 6°06.10 | C- | ||
| 6 | CL 71 | P | 125 | 132 | 280 | 42°57'35 | 6°08'54 | 42°57.49 | 6°09.34 | C | B | |
| 6 | CL 72 | P | 230 | 212 | 85 | 42°57'04 | 6°07'06 | 42°57.18 | 6°06.33 | DF | B | |
| 6 | CL 73 | P | 320 | 180 | 270 | 42°57'17 | 6°06'47 | 42°57.20 | 6°07.69 | L | ||
| 6 | CL 74 | P | 410 | 375 | 90 | 42°56.70 | 6°07.46 | 42°56.56 | 6°07.97 | D- | ||
| 6 | CL 75 | P | 400 | 310 | 120 | 42°56'11 | 6°08'37 | 42°56.56 | 6°08.19 | DF- | ||
| 6 | A 76 | P | 320 | 350 | 110 | 42°55'31 | 6°09'44 | 42°55.93 | 6°09.08 | L | ||
| 6 | CL 77 | P | 280 | 230 | 45 | 42°55.32 | 6°10.76 | 42°55.78 | 6°11.22 | DF- | B | |
| 6 | CL 78 | P | 900 | 590 | 45 | 42°55.35 | 6°12.57 | 42°56.16 | 6°13.41 | DF- | ||
| 6 | CL 79 | P | 400 | 270 | 235 | 42°55'56 | 6°11'49 | 42°56.07 | 6°13.29 | L | ||
| 6 | CL 80 | P | 1200 | 1100 | 310 | 42°54'51 | 6°07'55 | 42°54.22 | 6°09.56 | D- | ||
| 7 | A 81 | B | 130 | 130 | 110 | 43°01.75 | 5°35.00 | D- | ||||
| 7 | A 82 | B | 130 | 133 | 320 | 43°01.60 | 5°35.10 | D | B | |||
| 7 | A 83 | B | 145 | 140 | 320 | 43°01.65 | 5°34.60 | DF | B | |||
| 7 | A 84 | B | 145 | 140 | 325 | 43°01.85 | 5°34.50 | DF | B | |||
| 7 | A 85 | B | 130 | 135 | 320 | 43°02.30 | 5°33.80 | L | ||||
| 7 | A 86 | B | 135 | 140 | 320 | 43°01.95 | 5°34.40 | C- | ||||
| 7 | A 87 | B | 140 | 140 | 310 | 43°01.95 | 5°34.40 | C | B | |||
| 7 | A 88 | B | 190 | 180 | 115 | 43°00.10 | 5°34.15 | D | B | |||
| 7 | A 89 | B | 200 | 195 | 305 | 42°59.10 | 5°33.85 | DF | B | |||
| 7 | A 90 | B | 190 | 210 | 310 | 42°59.10 | 5°33.65 | L | ||||
| 7 | A 91 | B | 195 | 200 | 290 | 42°59.10 | 5°33.40 | C- | B | |||
| 7 | A 92 | B | 245 | 250 | 42°59.40 | 5°33.25 | D- | |||||
| 7 | A 93 | B | 245 | 250 | 42°59.70 | 5°32.90 | D- | |||||
| 7 | A 94 | B | 250 | 260 | 42°59.65 | 5°33.15 | DF | B | ||||
| 7 | A 95 | B | 245 | 280 | 42°59.60 | 5°33.05 | L | |||||
| 7 | A 96 | P | 150 | 145 | 325 | 42°57.20 | 6°08.25 | D | ||||
| 7 | A 97 | P | 155 | 145 | 42°57.20 | 6°08.25 | DF | B | ||||
| 7 | A 98 | P | 150 | 140 | 42°57.20 | 6°07.50 | L | |||||
| 7 | A 99 | P | 170 | 220 | 310 | 42°51.25 | 6°07.10 | D | ||||
| 7 | A 100 | P | 195 | 210 | 120 | 42°57.20 | 6°07.30 | DF- | B | |||
| 7 | A 101 | P | 220 | 190 | 115 | 42°57.15 | 6°08.10 | L | ||||
| 7 | A 102 | P | 143 | 138 | 100 | 42°58.00 | 6°07.90 | DF | B | |||
| 7 | A 103 | P | 128 | 130 | 340 | 42°58.40 | 6°07.60 | DF | B | |||
| 7 | A 104 | P | 260 | 220 | 300 | 42°57.05 | 6°08.10 | DF | B | |||
| 7 | A 105 | P | 280 | 260 | 100 | 42°57.05 | 6°07.70 | D | ||||
| 7 | A 106 | P | 240 | 260 | 300 | 42°57.10 | 6°07.30 | L | ||||
| 7 | A 107 | P | 125 | 120 | 140 | 42°57.30 | 6°09.40 | DF | B | |||
| 7 | A 108 | P | 150 | 140 | 320 | 42°57.00 | 6°08.90 | D | ||||
| 8 | TG 109 | B | 420 | 150 | 0 | 42°58'43 | 5°34'30 | 43°01'13 | 5°34'28 | SUBM | B | |
| 9 | K 110 | B | 445 | 469 | 310 | 0.20 | 42°59.00 | 5°33.00 | 42°59.00 | 5°32.80 | DF | |
| 9 | K 111 | B | 537 | 546 | 95 | 0.18 | 42°58.83 | 5°33.54 | 42°58.78 | 5°33.78 | D- | |
| 9 | K 112 | B | 439 | 463 | 275 | 0.12 | 42°59.06 | 5°32.98 | 42°59.08 | 5°32.82 | D- | |
| 9 | K 113 | B | 473 | 475 | 100 | 0.69 | 42°58.88 | 5°33.45 | 42°58.63 | 5°34.37 | L | |
| 9 | K 114 | B | 362 | 378 | 300 | 0.15 | 42°59.04 | 5°34.06 | 42°59.06 | 5°33.88 | DF | |
| 9 | K 115 | B | 353 | 358 | 130 | 0.20 | 42°58.48 | 5°35.15 | 42°58.30 | 5°35.41 | D | |
| 9 | K 116 | B | 352 | 42°58.28 | 5°35.57 | B | ||||||
| 9 | K 117 | B | 300 | 302 | 260 | 0.19 | 42°59.23 | 5°34.58 | 42°59.41 | 5°34.34 | D | |
| 9 | K 118 | B | 302 | 42°59.41 | 5°34.34 | B | B | |||||
| 9 | K 119 | B | 270 | 259 | 120 | 0.61 | 42°59.11 | 5°34.97 | 42°58.69 | 5°35.74 | L | |
| 9 | k 120 | B | 151 | 149 | 310 | 0.16 | 43°00.18 | 5°34.71 | 43°00.53 | 5°34.58 | DF | |
| 9 | K 121 | B | 147 | 43°00.70 | 5°34.49 | B | ||||||
| 9 | K 122 | B | 146 | 149 | 150 | 0.17 | 43°00.45 | 5°34.91 | 42°59.64 | 5°35.49 | L | |
| 9 | K 123 | B | 148 | 147 | 310 | 0.20' | 43°00.05 | 5°35.20 | 43°00.36 | 5°34.97 | D | |
| 9 | K 124 | B | 147 | 149 | 150 | 0.82' | 43°00.00 | 5°35.20 | 42°59.48 | 5°36.06 | C | B |
| 9 | K 125 | B | 155 | 160 | 290 | 0.82 | 42°59.10 | 5°35.60 | 43°00.14 | 5°34.59 | C | B |
| 9 | K 126 | B | 166 | 43°00.49 | 5°33.80 | B | ||||||
| 9 | K 127 | B | 191 | 189 | 290 | 0.21 | 43°00.54 | 5°33.37 | 43°00.71 | 5°33.12 | D | B |
| 9 | K 128 | B | 192 | 43°00.59 | 5°33.22 | B | ||||||
| 9 | K 129 | B | 188 | 170 | 130 | 0.76 | 43°00.35 | 5°33.90 | 42°59.91 | 5°35.00 | L- | |
| 9 | K 130 | B | 118 | 119 | 270 | 0.15 | 43°02.10 | 5°34.80 | 43°02.29 | 5°34.44 | DF | B |
| 9 | K 131 | B | 115 | 120 | 0 | 0.16 | 43°03.00 | 5°33.80 | 43°03.32 | 5°33.83 | DF | B |
| 9 | K132 | P | 170 | 193 | 90 | 0.17 | 42°57.22 | 6°08.00 | 42°56.94 | 6°OS.18 | D- | B |
| 9 | K 133 | P | 200 | 42°57.21 | 6°08.03 | B | ||||||
| 9 | K 134 | P | 190 | 200 | 0.17 | 42°57.30 | 6°06.90 | 42°57.22 | 6°06.62 | DF | B | |
| 9 | K 135 | P | 133 | 126 | 0.14 | 42°58.16 | 6°08.11 | 42°58.11 | 6°07.49 | DF- | ||
| 9 | K 136 | P | 132 | 42°57.86 | 6°08.41 | B | ||||||
| 9 | K 137 | P | 131 | 130 | 315 | 0.14 | 42°58.04 | 6°08.06 | 42°58.16 | 6°07.89 | DF | B |
| 9 | K 138 | P | 131 | 129 | 127 | 0.76 | 42°58.14 | 6°07.94 | 42°57.67 | 6°08.56 | L | |
| 9 | K 139 | P | 302 | 294 | 280 | 0.32 | 42°57.00 | 6°07.84 | 42°57.05 | 6°07.31 | D | |
| 9 | K 140 | P | 180 | 183 | 270 | 0.29 | 42°57.27 | 6°07.22 | 42°57.24 | 6°06.84 | SF | B |
| 9 | K 141 | P | 183 | 42°57.24 | 6°06.84 | B | ||||||
| 9 | K 142 | P | 387 | 395 | 90 | 0.15 | 42°56.68 | 6°07.88 | 42°56.61 | 6°07.94 | D- | |
| 9 | K 143 | P | 395 | 42°56.61 | 6°07.94 | B | ||||||
| 9 | K 144 | P | 415 | 419 | 140 | 0.18 | 42°56.50 | 6°08.00 | 42°56.36 | 6°08.10 | DF | |
| 9 | K 145 | P | 393 | 457 | 320 | 0.77 | 42°56.50 | 6°07.50 | 42°56.75 | 6°06.96 | L | |
| 9 | K 146 | P | 100 | 99 | 350 | 0.21 | 42°59.00 | 6°08.73 | 42°59.29 | 6°08.52 | DF | |
| 9 | K 147 | P | 99 | 42°59.26 | 6°08.47 | B | ||||||
| 9 | K 148 | P | 129 | 130 | 130 | 0.53 | 42°58.85 | 6°07.00 | 42°58.41 | 6°07.55 | C | B |
| 10 | TG 149 | P | 600 | 80 | 20 | 42°56.000 | 6°07.20 | 42°59.40 | 6°09.20 | SUBM | B | |
Profondeurs en mètres et coordonnées du début [D] et fin [F] de traict sur le fond. Les distances sont en milles nautiques.
BRAPROV 1 : 28 février au 2 mars 198( (N/O Antedon)
BRAPROV 2 : 27 janvier 1986 (BISM Triton & SMI Griffon)
BRAPROV 3 : 11 au 14 décembre 1986 (N/O Antedon)
BRAPROV 4 : 12 au 16 janvier 1987 (N/O Catherine-Laurence & ROV Modea)
BRAPROV 5 : 4 au 6 mars 1987 (N/O Antedon)
BRAPROV 6 : 30 mars au 3 avril 1987 (N/O Catherine-Laurence)
BRAPROV 7 : 1 au 5 juin 1987 (N/O Antedon)
BRAPROV 8 : 22 octobre 1987 (BISM Triton & SMI Griffon)
BRAPROV 9 : 16 au 25 novembre 1987 (N/O Korotneff)
BRAPROV 10 : 13 octobre 1989 (BISM Triton & SMI Griffon)
Engins de prélèvement : B = benne Shipeck ; C = petit chalut à perche (2m de large) ; D = drague Charcot-Picard avec caleçon (toile de jute) ; DF = drague Charcot-Picard (sans caleçon) avec un filet de 10mm de maille, protégé par un filet de 10 à grosse maille ; L = luge ; ROV = remotely operated vehicle ou véhicule sous-marin téléguidé ; SUBM = submersibe. - : indique un prélévement incomplet ou vide (avarie).
Tableau 4 : Répartition des brachiopodes (en nombre d'individus) dans les stations des campagnes BraProv (Tableau 3). Figures 9-2 et 9-3. Dans certaines stations, des comptages ont été effectués sur les Gryphus selon la couleur de la coquille blanche ou verte colonisées par l'algue Ostreobium. Pour la légende complète : voir Tableau 3.
|
Campagne et Stations |
Zones | Profondeur [ D - F ] |
Dist [milles] | Engins | Gryphus |
Gryphus
b / v |
Terebratulina | Megerlia | Megathiris | Novocrania | Platidia | ||
| 0 | A1 | 0 | DF | ||||||||||
| 0 | A2 | 160 | DF | ||||||||||
| 0 | A3 | DF | |||||||||||
| 0 | A4 | 145 | DF | ||||||||||
| 0 | A5 | 160 | DF | ||||||||||
| 0 | A6 | 250 | 220 | DF | |||||||||
| 1 | A 2 | 240 | 130 | DF- | 10 | 10 | 10 | ||||||
| 1 | A3 | 140 | 100 | DF | 10 | ||||||||
| 1 | A4 | 240 | ? | DF | 60 | ||||||||
| 1 | A6 | 250 | 280 | DF- | 40 | 10 | 10 | ||||||
| 1 | A 9 | B | 180 | ? | DF | 10 | 2 | ||||||
| 1 | A 11 | B | 200 | ? | DF | 20 | 40 | ||||||
| 1 | A 13 | B | 250 | 160 | DF | 90 | 2 | 15 | 1 | ||||
| 1 | A 14 | B | 280 | 155 | DF | 25 | |||||||
| 1 | A 15 | B | 250 | 155 | DF | 100 | 60 | 60 | |||||
| 2 | TG 16 | M | 345 | 70 | SUBM | +++ | |||||||
| 3 | A 17 | B | 200 | 140 | DF- | 20 | /0 | ||||||
| 3 | A 18 | B | 200 | 160 | DF | 4 | /0 | 1 | |||||
| 3 | A 19 | B | 160 | 180 | DF | 49 | 40/9 | ||||||
| 3 | A 20 | M | 110 | 105 | DF | 38 | 6/32 | 2 | 12 | 1 | |||
| 3 | A 22 | M | 120 | 130 | DF | 34 | 19/15 | 6 | 14 | 7 | 3 | ||
| 3 | A 24 | M | 120 | 160 | DF | 56 | 44/12 | 25 | 67 | 16 | 1 | ||
| 3 | A 25 | M | 245 | 235 | DF- | 7 | /0 | ||||||
| 3 | A 26 | M | 245 | 210 | D- | 40 | 20 | 60 | |||||
| 3 | A 27 | M | 200 | 120 | DF- | 10 | 8/2 | ||||||
| 3 | A29 | M | 180 | 120 | DF | 140 | /0 | 4 | 17 | ||||
| 3 | A 30 | PC | 220 | 160 | DF | 10 | /0 | 2 | |||||
| 3 | A 32 | PC | 120 | 110 | DF | 2 | /0 | 1 | |||||
| 3 | A 35 | B | 180 | 260 | DF- | 5 | /0 | ||||||
| 3 | A 36 | B | 175 | 180 | DF | 10 | /0 | 3 | 14 | ||||
| 3 | A 39 | B | 180 | 155 | DF | 137 | /0 | ||||||
| 5 | A 45 | B | 140 | 140 | DF | 24 | /0 | 4 | |||||
| 5 | A 46 | B | 150 | 140 | DF | 6 | /0 | ||||||
| 5 | A 48 | B | 130 | 125 | D | 1 | /0 | ||||||
| 5 | A 49 | B | 130 | 125 | L | 300 | 2 | 6 | 1 | 2 | |||
| 5 | A 52 | B | 155 | 160 | C | 2000 | 4 | 8 | 4 | ||||
| 5 | A 54 | B | 160 | 160 | D | 1 | /0 | ||||||
| 5 | A 55 | B | 250 | 260 | D | 3 | /0 | ||||||
| 5 | A 57 | B | 240 | 230 | C- | 68 | /0 | 2 | 5 | 2 | |||
| 6 | A 59 | PC | 120 | 96 | DF | 5 | /0 | 12 | 25 | ||||
| 6 | A 60 | PC | 170 | 140 | D- | 20 | /0 | 20 | 20 | ||||
| 6 | A 61 | PC | 250 | 130 | DF | 5 | /0 | 5 | 8 | ||||
| 6 | A 62 | PC | 150 | 160 | DF | 20 | /0 | 20 | 20 | ||||
| 6 | A 66 | P | 130 | 129 | DF | 70 | /0 | 1 | |||||
| 6 | A 67 | P | 132 | 132 | DF | 250 | /0 | ||||||
| 6 | A 71 | P | 125 | 132 | C | 1500 | 1 | 5 | 1 | ||||
| 6 | A 72 | P | 230 | 212 | DF | 10 | /0 | ||||||
| 6 | A 77 | P | 280 | 230 | DF- | 2 | /0 | ||||||
| 7 | A 82 | B | 130 | 133 | D | 20 | |||||||
| 7 | A 83 | B | 145 | 140 | DF | 22 | /0 | ||||||
| 7 | A 84 | B | 145 | 140 | DF | 85 | 83/2 | 5 | 2 | ||||
| 7 | A 87 | B | 140 | 140 | C | >1000 | 2 | 60 | 1 | ||||
| 7 | A 88 | B | 190 | 180 | D | 10 | 10 | 10 | 10 | ||||
| 7 | A 89 | B | 200 | 195 | DF | 163 | |||||||
| 7 | A 91 | B | 195 | 200 | C- | 20 | 2 | 20 | 10 | ||||
| 7 | A 94 | B | 250 | 260 | DF | 20 | |||||||
| 7 | A 97 | P | 155 | 145 | DF | 127 | |||||||
| 7 | A 100 | P | 195 | 210 | DF- | 12 | |||||||
| 7 | A 102 | P | 143 | 138 | DF | 55 | |||||||
| 7 | A 103 | P | 128 | 130 | DF | 52 | |||||||
| 7 | A 104 | P | 260 | 220 | DF | 2 | |||||||
| 7 | A 107 | P | 125 | 120 | DF | 33 | |||||||
| 8 | TG 109 | B | 420 | 150 | SUBM | +++ | |||||||
| 9 | K 118 | B | 302 | B | 12 | ||||||||
| 9 | K 124 | B | 147 | 149 | 0.82 | C | 80 | 10 | 80 | 40 | 10 | 10 | |
| 9 | K 125 | B | 155 | 160 | 0.82 | C | 80 | 10 | 80 | 40 | 10 | 10 | |
| 9 | K 127 | B | 191 | 189 | 0.21 | D | 80 | ||||||
| 9 | K 130 | B | 118 | 119 | 0.15 | DF | 6 | ||||||
| 9 | K 131 | B | 115 | 120 | 0.16 | DF | 12 | ||||||
| 9 | K132 | P | 170 | 193 | 0.17 | D- | 12 | ||||||
| 9 | K 134 | P | 190 | 200 | 0.17 | DF | 34 | ||||||
| 9 | K 137 | P | 131 | 130 | 0.14 | DF | 50 | ||||||
| 9 | K 140 | P | 180 | 183 | 0.29 | DF | 32 | ||||||
| 9 | K 148 | P | 129 | 130 | 0.53 | C | 500 | ||||||
| 10 | TG 149 | P | 600 | 80 | SUBM | +++ | |||||||
Tableau 5 : Campagne IsoBra (CNRS ; chef de mission : Christian C. Emig) avec le N/O Catherine-Laurence: st. IB 2-6 en septembre 1996 et st. IB 9 en mars 1999 - engin: drague Charcot-Picard à filets (DF). Campagne DEPROG (IFREMER) avec le N/O Europe en avril 1996 - engin : chalut à perche. Figures 9-1 et 9-2.
[D] sont les données lors de la mise à l'eau de l'engin ; [F] au moment de la remontée de l'engin. Cap du traict et le nombre de Gryphus récoltés. Seules les stations avec brachiopodes sont listées.
|
Campagne et Stations |
Profondeur [ D - F ] |
Latitude N [D] | Longitude E [D] | Latitude N [F] | Longitude E [F] | cap en° | Gryphus | |
| IsoBra IB 2 DF | 128 | 129 | 43°02'.54 | 5°33'.26 | 43°02'.15 | 5°33'.71 | 275 | 3 |
| IsoBra IB 4 DF | 156 | 157 | 43°01'.11 | 5°32'.67 | 43°01'.44 | 5°31'.44 | 280 | 200 |
| IsoBra IB 6 DF | 162 | 155 | 43°01'.85 | 5°30'.55 | 43°02'.34 | 5°30'.38 | 280 | 200 |
| IsoBra IB 9 DF | 155 | 154 | 43°02'.29 | 5°30'.28 | 43°02'.01 | 5°30'.69 | 150 | 180 |
| DEPROG D-2 | 986 | 1030 | 42°43'.57 | 4°46'.99 | 42°42'.55 | 4°46'.60 | 2 | |
| DEPROG D-3 | 1129 | 1193 | 42°44'.57 | 4°29'.47 | 42°43'.90 | 4°29'.50 | 5 | |
| DEPROG D-4 | 1096 | 1179 | 42°34'.68 | 4°07'.40 | 42°33'.37 | 4°08'.19 | 4 | |
| DEPROG D-5 | 1136 | 1157 | 42°28'.52 | 4°05'.74 | 42°27'.66 | 4°07'.00 | 3 | |
| DEPROG D-6 | 1600 | 1630 | 42°20'.73 | 3°58'.93 | 42°19'.92 | 4°00'.45 | 1 | |
| DEPROG D-14 | 1153 | 1275 | 42°15'.67 | 3°42'.90 | 42°14'.27 | 3°44'.25 | 1 | |
| DEPROG D-17 | 744 | 725 | 42°29'.60 | 3°40'.34 | 42°29'.30 | 3°40'.85 | 2 | |
Tableau 6 : Campagnes BraCors (CNRS ; chef de mission : Christian C. Emig). Figures 9-4, 9-5, 9-6, 9-7 et 9-8.
[Légende en fin de tableau]
| Campagnes et Stations |
Prof [D - F]
|
Cap
|
Latitude N [D]
|
Longitude E [D]
|
Latitude N [F]
|
Longitude E [F]
|
Engin | Brachiopoda |
| 1 CL 1 |
125 125
|
50
|
42°32'52
|
8°39'15
|
42°33'01
|
8°39'42
|
B | |
| 1 CL 1 |
130
|
|
42°33'03
|
8°39'38
|
|
|
B | |
| 1 CL 1 |
125 125
|
|
42°33'03
|
8°39'38
|
42°32'50
|
8°39'18
|
B | |
| 3 CL 1/2 |
146 150
|
0
|
42°32'53
|
8°39'15
|
42°33'21
|
8°39'10
|
B | |
| 3 CL 1/2 |
153 148
|
180
|
42°33'21
|
8°39'10
|
42°33'00
|
8°39'12
|
B | |
| 1 CL 2 |
125 135
|
0
|
42°32'58
|
8°39'08
|
42°33'35
|
8°39'07
|
B | |
| 1 CL 2 |
135
|
|
42°33'35
|
8°39'07
|
|
|
B | |
| 4 CL 2-85 |
125 130
|
10
|
42°32'48
|
8°39'06
|
42°33'39
|
8°38'47
|
B- | |
| 4 CL 2-85 |
135 140
|
220
|
42°33'48
|
8°38'46
|
42°33'37
|
8°38'16
|
B | |
| 1 CL 3 |
130 130
|
25
|
43°33'27
|
8°39'03
|
43°33'40
|
8°39'13
|
B | |
| 1 CL 4 |
138 130
|
80
|
43°34'22
|
8°40'08
|
43°34'27
|
8°40'37
|
B | |
| 1 CL 4 |
138
|
|
43°34'23
|
8°40'32
|
|
|
- | |
| 1 CL 5 |
120 120
|
202
|
42°34'15
|
8°41'03
|
42°33'38
|
8°40'55
|
C | |
| 1 CL 6 |
140 135
|
120
|
42°33'59
|
8°39'50
|
42°33'48
|
8°40'13
|
- | |
| 1 CL 7 |
120 100
|
120
|
42°33'32
|
8°40'35
|
42°33'10
|
8°41'12
|
C | |
| 1 CL 8 |
135 130
|
72
|
42°34'06
|
8°39'30
|
42°34'13
|
8°40'00
|
C- | |
| 1 CL 9 |
130 130
|
72
|
42°34'15
|
8°40'08
|
42°34'20
|
8°40'30
|
B | |
| 1 CL 10 |
130 105
|
76
|
42°34'34
|
8°41'05
|
42°34'37
|
8°41'28
|
B | |
| 1 CL 11 |
130 110
|
76
|
42°34'36
|
8°41'27
|
42°34'37
|
8°41'35
|
B | |
| 1 CL 12 |
110
|
|
42°34'35
|
8°41'23
|
|
|
B | |
| 1 CL 12 |
125 105
|
76
|
42°34'36
|
8°41'27
|
42°34'37
|
8°41'23
|
B | |
| 1 CL 13 |
120 100
|
90
|
42°31'41
|
8°36'38
|
42°31'43
|
8°37'16
|
B | |
| 4 CL 13-1 |
140
|
100
|
42°31'18
|
8°35'43
|
42°31'17
|
8°35'46
|
B | |
| 4 CL 13-2 |
150 160
|
210
|
42°31'42
|
8°35'18
|
42°31'18
|
8°35'06
|
B | |
| 4 CL 13-3 |
130 110
|
40
|
42°31'51
|
8°36'15
|
42°32'04
|
8°36'34
|
DF- | |
| 4 CL 13-4 |
115 120
|
220
|
42°32'12
|
8°36'52
|
|
|
DF- | |
| 4 CL 13-5 |
130 135
|
220
|
42°31'29
|
8°36'18
|
42°31'47
|
8°36'28
|
DF | |
| 4 CL 13-6 |
125 125
|
70
|
42°32'09
|
8°37'12
|
|
|
B | |
| 4 CL 13-7 |
110 115
|
|
42°31'57
|
8°37'17
|
42°31'50
|
8°36'34
|
B | |
| 4 CL 13-8 |
110 115
|
220
|
42°31'54
|
8°37'17
|
|
|
DF- | |
| 4 CL 13-9 |
115 120
|
220
|
42°32'09
|
8°37'17
|
|
|
DF- | |
| 4 CL 13-10 |
120 125
|
240
|
42°31'57
|
8°36'57
|
42°31'53
|
8°36'49
|
DF | |
| 4 CL 13-11 |
120 120
|
60
|
42°31'56
|
8°37'06
|
42°32'00
|
8°36'16
|
B | |
| 4 CL 13-12 |
105 110
|
240
|
42°31'48
|
8°37'01
|
42°31'43
|
8°36'42
|
DF | |
| 5 CL 13-13 |
140 140
|
25
|
42°31'48
|
8°36'00
|
42°32'18
|
8°36'42
|
B | |
| 5 CL 13-14 |
135 135
|
25
|
42°31'42
|
8°36'30
|
42°32'18
|
8°36'48
|
B | |
| 5 CL 13-14 |
136
|
|
42°32'18
|
8°36'48
|
|
|
B | |
| 5 CL 13-15 |
117
|
|
42°31'42
|
8°34'30
|
|
|
B | |
| 5 CL 13-16 |
128 115
|
|
42°31'27
|
8°36'33
|
42°31'54
|
8°36'77
|
B | |
| 5 CL 13-17 |
142 137
|
|
42°31'48
|
8°36'00
|
42°32'30
|
8°37'15
|
D* | |
| 5 CL 13-18 |
125 125
|
70
|
42°31'47
|
8°37'00
|
42°32'08
|
8°37'27
|
B | |
| 5 CL 13-19 |
107 98
|
70
|
42°31'50
|
8°37'00
|
42°31'47
|
8°37'17
|
B | |
| 5 CL 13-20 |
135 127
|
70
|
42°32'17
|
8°37'10
|
42°32'21
|
8°37'37
|
B | |
| 5 CL 13-21 |
123 110
|
70
|
42°31'43
|
8°36'43
|
42°31'50
|
8°37'10
|
B | |
| 1 CL 14 |
115 105
|
70
|
42°31'06
|
8°36'56
|
42°31'03
|
8°37'28
|
B | |
| 1 CL 14 |
105
|
|
42°31'02
|
8°37'30
|
|
|
B | |
| 3 CL 14 |
140 85
|
90
|
42°31'05
|
8°36'55
|
42°31'33
|
8°37'43
|
B | |
| 1 CL 15 |
100 95
|
90
|
42°30'41
|
8°36'42
|
42°30'42
|
8°37'06
|
B | |
| 1 CL 15 |
95
|
|
42°30'42
|
8°37'06
|
|
|
B | |
| 3 CL 15 |
110 98
|
90
|
42°30'42
|
8°36'38
|
42°30'40
|
8°37'22
|
B | |
| 3 CL 15bis |
150 97
|
90
|
42°30'45
|
8°36'27
|
42°30'43
|
8°37'19
|
B | |
| 3 CL 15bis |
96
|
|
42°30'38
|
8°37'05
|
|
|
B | |
| 3 CL 15b2 |
155 139
|
90
|
42°30'45
|
8°36'27
|
42°30'55
|
8°36'52
|
B | |
| 3 CL 15b3 |
160 143
|
90
|
42°30'45
|
8°36'23
|
42°30'38
|
8°36'35
|
B | |
| 3 CL 15b4 |
160 135
|
90
|
42°30'48
|
8°30'05
|
42°30'37
|
8°36'45
|
B | |
| 3 CL 15b5 |
145
|
|
42°32'55
|
8°39'15
|
|
|
B | |
| 3 CL 15ter |
145 97
|
90
|
42°30'55
|
8°36'30
|
42°30'43
|
8°37'19
|
DF- | |
| 3 CL 15-4 |
110 110
|
210
|
42°31'03
|
8°37'30
|
42°30'37
|
8°37'20
|
B | |
| 1 CL 16 |
140 105
|
90
|
42°32'27
|
8°36'53
|
42°32'13
|
8°37'47
|
B | |
| 1 CL 16 |
105
|
|
42°32'13
|
8°37'47
|
|
|
B | |
| 1 CL 17 |
130 140
|
218
|
42°36'23
|
8°40'58
|
42°35'54
|
8°40'27
|
B | |
| 1 CL 18 |
130 135
|
218
|
42°36'03
|
8°41'27
|
42°36'02
|
8°40'52
|
B | |
| 1 CL 18 |
130 135
|
|
42°36'07
|
8°40'57
|
|
|
B | |
| 1 CL 19 |
68 72
|
240
|
42°39'24
|
8°51'55
|
42°39'12
|
8°51'30
|
DF | |
| 1 CL 19 |
71
|
|
42°39'12
|
8°51'30
|
|
|
B | |
| 1 CL 20 |
85 90
|
240
|
42°39'37
|
8°51'30
|
42°39'32
|
8°51'07
|
DF | |
| 1 CL 20 |
90
|
|
42°39'32
|
8°51'07
|
|
|
B | |
| 1 CL 21 |
93 90
|
240
|
42°39'42
|
8°50'37
|
42°39'25
|
8°50'02
|
B | |
| 3 CL 21 |
105 105
|
60
|
42°39'25
|
8°50'00
|
42°39'33
|
8°50'07
|
B | |
| 3 CL 21-2 |
112 112
|
60
|
42°39'33
|
8°50'07
|
42°39'46
|
8°50'12
|
D | |
| 4 CL 21 |
100 85
|
180
|
42°39'45
|
8°50'22
|
42°39'31
|
8°50'16
|
DF | |
| 4 CL 21-1 |
100 95
|
80
|
42°39'33
|
8°48'49
|
42°39'31
|
8°49'13
|
DF | |
| 4 CL 21-2 |
105 95
|
180
|
42°40'
|
8°50'
|
42°39'46
|
8°49'27
|
DF | |
| 1 CL 22 |
116 125
|
245
|
42°40'29
|
8°49'15
|
42°40'23
|
8°48'50
|
B | |
| 1 CL 22 |
125
|
|
42°40'23
|
8°48'50
|
|
|
B | |
| 1 CL 23 |
120 130
|
245
|
42°40'28
|
8°48'55
|
42°40'12
|
8°48'15
|
B | |
| 1 CL 23 |
130
|
|
42°40'12
|
8°48'15
|
|
|
B | |
| 1 CL 24 |
160 150
|
65
|
42°39'05
|
8°44'47
|
42°39'32
|
8°45'42
|
C | |
| 1 CL 24 |
150
|
|
42°39'32
|
8°45'42
|
|
|
B | |
| 1 CL 25 |
123 128
|
233
|
42°38'53
|
8°46'23
|
42°38'35
|
8°46'10
|
B | |
| 1 CL 25 |
126
|
|
42°38'44
|
8°46'25
|
|
|
B | |
| 1 CL 26 |
140 145
|
235
|
42°39'08
|
8°45'00
|
42°38'54
|
8°45'33
|
B | |
| 1 CL 26 |
145
|
|
42°39'03
|
8°46'52
|
|
|
B* | |
| 3 CL 26 |
150 150
|
55
|
42°38'54
|
8°45'33
|
42°39'17
|
8°45'47
|
B | |
| 3 CL 26 |
150 150
|
205
|
42°39'17
|
8°45'47
|
42°39'04
|
8°45'38
|
D | |
| 4 CL 26 |
135 140
|
235
|
42°39'19
|
8°45'54
|
42°39'05
|
8°45'31
|
B | |
| 4 CL 26-1 |
155 160
|
235
|
42°38'51
|
8°44'20
|
42°38'45
|
8°43'48
|
B | |
| 1 CL 27 |
165 145
|
165
|
42°39'27
|
8°45'15
|
42°38'52
|
8°45'15
|
B | |
| 1 CL 27 |
148
|
|
42°39'08
|
8°45'18
|
|
|
B | |
| 1 CL 28 |
92 78
|
180
|
42°35'40
|
8°46'08
|
42°35'17
|
8°46'06
|
DF | |
| 1 CL 29 |
72 68
|
180
|
42°35'18
|
8°46'14
|
42°34'55
|
8°46'07
|
DF | |
| 1 CL 30 |
300 250
|
235
|
42°37'45
|
8°43'52
|
42°37'12
|
8°43'23
|
B | |
| 1 CL 31 |
200 120
|
235
|
42°36'30
|
8°44'30
|
42°36'09
|
8°44'06
|
B | |
| 1 CL 32 |
110 110
|
80
|
42°42'16
|
8°56'22
|
42°42'25
|
8°56'41
|
DF- | |
| 1 CL 33 |
?300 200
|
165
|
42°41'32
|
8°59'08
|
42°40'35
|
8°59'53'
|
DF | |
| 1 CL 34 |
200 150
|
140
|
42°45'15
|
9°00'50
|
|
|
DF- | |
| 1 CL 34' |
160 140
|
140
|
42°44'52
|
9°01'05
|
42°44'13
|
9°01'13
|
B | |
| 1 CL 34' |
145
|
|
42°44'17
|
9°01'09
|
|
|
B | |
| 3 CL 34' |
?
|
|
42°44'50
|
9°01'05
|
|
|
D* | |
| 3 CL 34'1 |
170 180
|
170
|
42°44'50
|
9°01'05
|
42°44'08
|
9°00'57
|
B | |
| 3 CL 34'2 |
? ?
|
170
|
42°44'50
|
9°01'05
|
42°44'38
|
9°01'00
|
D- | |
| 3 CL 34'3 |
? ?
|
170
|
42°44'38
|
9°01'00
|
42°44'12
|
9°00'47
|
D- | |
| 3 CL 34'4 |
? ?
|
170
|
42°44'38
|
9°01'00
|
42°44'16
|
9°00'40
|
D- | |
| 1 CL 35 |
105 125
|
40
|
42°44'15
|
9°02'00
|
42°44'36
|
9°02'15
|
B | |
| 1 CL 35 |
125
|
|
42°44'36
|
9°02'15
|
|
|
B | |
| 3 CL 35-1 |
150 150
|
30
|
42°44'15
|
9°01'57
|
42°45'03
|
9°02'05
|
B | |
| 3 CL 35-2 |
150 150
|
180
|
42°45'03
|
9°02'05
|
|
|
D* | |
| 1 CL 36 |
?370 210
|
235
|
42°41'42
|
8°58'25
|
42°41'35
|
8°38'18
|
DF- | |
| 1 CL 37 |
58 55 135
|
|
42°43'54
|
9°02'12
|
42°43'47
|
9°03'13
|
DF | |
| 1 CL 38 |
117 120
|
135
|
42°42'38
|
9°01'12
|
42°42'29
|
9°01'39
|
B | |
| 1 CL 39 |
?220 180
|
200
|
42°42'52
|
8°57'37
|
42°42'35
|
8°57'31
|
B | |
| 1 CL 39 |
215
|
|
42°42'55
|
8°57'45
|
|
|
B | |
| 1 CL 40 |
115 110
|
245
|
42°40'02
|
8°49'00
|
42°39'45
|
8°48'28
|
DF | |
| 1 CL 40 |
110
|
|
42°40'04
|
8°48'43
|
|
|
B | |
| 1 CL 41 |
125 125
|
60
|
42°40'30
|
8°48'15
|
42°41'00
|
8°49'00
|
B | |
| 1 CL 41 |
122
|
|
42°40'58
|
8°49'05
|
|
|
B | |
| 1 CL 42 |
135 123
|
220
|
42°41'10
|
8°49'16
|
42°40'52
|
8°49'00
|
B | |
| 1 CL 42 |
125
|
|
42°41'00
|
8°49'07
|
|
|
B | |
| 1 CL 43 |
145 230
|
230
|
42°41'34
|
8°48'12
|
42°40'53
|
8°47'40
|
B | |
| 1 CL 43 |
150
|
|
42°41'00
|
8°47'46
|
|
|
B | |
| 1 CL 44 |
180 136
|
230
|
42°41'08
|
8°46'17
|
42°40'51
|
8°45'55
|
B | |
| 1 CL 44 |
163
|
|
42°40'50
|
8°45'59
|
|
|
B | |
| 3 CL 44bis |
? ?
|
55
|
42°41'07
|
8°46'16
|
|
|
DF- | |
| 1 CL 45 |
160 ?
|
50
|
42°40'54
|
8°46'04
|
42°41'18
|
8°46'48
|
DF- | |
| 1 CL 46 |
170 150
|
190
|
42°41'30
|
8°47'03
|
42°40'44
|
8°47'03
|
B | |
| 1 CL 46 |
149
|
|
42°40'46
|
8°47'04
|
|
|
B | |
| 3 CL 46bis |
280 220
|
55
|
42°41'21
|
8°47'00
|
42°41'18
|
8°47'00
|
DF- | |
| 3 CL 46b |
280 220
|
180
|
42°41'18
|
8°47'00
|
42°41'06
|
8°47'09
|
D* | |
| 4 CL 46 |
150 135
|
160
|
42°41'15
|
8°46'49
|
42°41'10
|
8°47'17
|
B | |
| 1 CL 47 |
170 143
|
180
|
42°41'37
|
8°47'08
|
42°40'46
|
8°47'44
|
B | |
| 1 CL 47 |
143
|
|
42°40'47
|
8°47'50
|
|
|
B | |
| 1 CL 48 |
? ?
|
170
|
42°41'50
|
8°46'21
|
42°41'15
|
8°46'48
|
DF- | |
| 1 CL 49 |
?150 130
|
270
|
42°46'27
|
9°13'38
|
42°46'33
|
9°13'18
|
B | |
| 1 CL 50 |
135 120
|
270
|
42°46'33
|
9°13'22
|
42°46'36
|
9°12'55
|
B | |
| 1 CL 51 |
? ?
|
245
|
42°43'53
|
9°12'58
|
42°45'37
|
9°12'30
|
DF | |
| 1 CL 52 |
160 115
|
245
|
42°45'37
|
9°12'33
|
42°45'28
|
9°12'05
|
B | |
| 3 CL 52 |
? ?
|
250
|
42°45'36
|
9°12'17
|
42°45'30
|
9°11'53
|
DF | |
| 3 CL 52-1 |
? ?
|
180
|
42°45'28
|
9°12'22
|
42°44'55
|
9°12'12
|
DF | |
| 1 CL 53 |
160 115
|
245
|
42°45'28
|
9°12'08
|
42°45'25
|
9°12'05
|
B | |
| 1 CL 54 |
120 60
|
245
|
42°45'30
|
9°12'15
|
42°45'23
|
9°11'38
|
DF | |
| 1 CL 55 |
150 115
|
245
|
42°45'40
|
9°12'30
|
42°45'31
|
9°12'18
|
D | |
| 1 CL 56 |
140 120
|
245
|
42°45'33
|
9°12'23
|
42°45'28
|
9°12'06
|
D | |
| 1 CL 57 |
? 150
|
245
|
42°45'44
|
9°12'40
|
42°45'43
|
9°12'22
|
DF | |
| 1 CL 58 |
? 150
|
245
|
42°45'42
|
9°12'34
|
42°45'35
|
9°12'23
|
DF | |
| 1 CL 59 |
? ?
|
245
|
42°45'48
|
9°12'85
|
42°45'43
|
9°12'21
|
DF- | |
| 1 CL 59' |
180 190
|
245
|
42°45'45
|
9°12'36
|
42°45'43
|
9°12'21
|
B | |
| 1 CL 60 |
? 180
|
200
|
42°46'00
|
9°13'52
|
42°45'32
|
9°13'26
|
B | |
| 1 CL 61 |
140 105
|
185
|
42°45'25
|
9°14'26
|
42°45'08
|
9°14'25
|
B | |
| 1 CL 62 |
140 110
|
205
|
42°43'55
|
9°17'30
|
42°43'35
|
9°17'12
|
DF | |
| 1 CL 63 |
150 105
|
135
|
42°47'27
|
9°18'10
|
42°47'10
|
9°18'25
|
B | |
| 1 CL 64 |
150 77
|
85
|
42°47'53
|
9°19'18
|
42°47'52
|
9°19'45
|
DF | |
| 1 CL 65 |
140 110
|
90
|
42°50'03
|
9°16'50
|
42°50'00
|
9°17'34
|
DF | |
| 1 CL 66 |
? ?
|
125
|
42°51'53
|
9°18'04
|
42°51'42
|
9°18'31
|
B | |
| 1 CL 67 |
130 85
|
20
|
42°54'08
|
9°16'52
|
42°54'25
|
9°16'56
|
DF | |
| 1 CL 68 |
115 95
|
50
|
42°54'03
|
9°17'21
|
42°54'27
|
9°17'40
|
B | |
| 1 CL 69 |
? ?
|
180
|
42°55'17
|
9°17'58
|
|
|
DF- | |
| 1 CL 70 |
210 130
|
60
|
42°57'04
|
9°18'32
|
42°57'20
|
9°18'50
|
B | |
| 1 CL 71 |
?
|
210
|
43°00'54
|
9°17'46
|
43°00'40
|
9°17'35
|
DF- | |
| 1 CL 72 |
190 160
|
210
|
43°00'45
|
9°17'30
|
43°00'37
|
9°17'15
|
B | |
| 1 CL 73 |
125 90
|
180
|
42°48'05
|
8°10'00
|
42°47'54
|
8°10'11
|
B | |
| 1 CL 74 |
110 170
|
205
|
42°48'08
|
8°09'32
|
42°47'43
|
8°09'22
|
B | |
| 3 CL 74 |
120 143
|
180
|
42°48'08
|
9°09'32
|
42°47'24
|
9°09'12
|
B | |
| 3 CL 74 |
152 150
|
180
|
42°48'08
|
9°09'32
|
42°47'57
|
9°09'15
|
B | |
| 3 CL 74-1 |
150 110
|
180
|
42°47'32
|
9°08'17
|
42°46'53
|
9°07'43
|
B | |
| 3 CL 74-2 |
150 90
|
155
|
42°46'25
|
9°06'08
|
42°46'15
|
9°06'2?
|
B | |
| 3 CL 74-3 |
200 180
|
150
|
Annulé
|
présence de
|
filets
|
|
B | |
| 3 CL 74-4 |
190 160
|
90
|
42°43'38
|
9°00'20
|
42°43'35
|
9°00'35
|
B | |
| 3 CL 74-5 |
? ?
|
90
|
42°43'20
|
9°00'37
|
42°43'57
|
9°01'28
|
DF | |
| 1 CL 75 |
? ?
|
180
|
42°41'36
|
8°47'08
|
42°41'10
|
8°47'07
|
DF | |
| 4 CL 75-85 |
140 135
|
180
|
42°41'36
|
8°47'11
|
42°41'
|
8°47'
|
DF | |
| 1 CL 76 |
? ?
|
155
|
42°41'30
|
8°47'00
|
|
|
DF | |
| 1 CL 77 |
? ?
|
150
|
42°41'25
|
8°47'18
|
42°41'10
|
8°47'50
|
DF | |
| 1 CL 78 |
? ?
|
180
|
42°41'25
|
8°47'18
|
42°41'00
|
8°47'22
|
DF | |
| 2 CL 79 |
150 95
|
200
|
41°38'47
|
8°49'27
|
41°58'22
|
8°49'12
|
DF | |
| 2 CL 80 |
150 140
|
130
|
41°39'03
|
8°46'54
|
41°38'47
|
8°47'00
|
B | |
| 2 CL 81 |
150
|
130
|
41°38'50
|
8°46'54
|
41°38'47
|
8°47'10
|
DF- | |
| 2 CL 82 |
145 115
|
130
|
41°38'54
|
8°47'03
|
41°38'42
|
8°47'25
|
DF | |
| 2 CL 83 |
123 97
|
130
|
41°38'36
|
8°47'24
|
41°38'32
|
8°47'30
|
B | |
| 2 CL 84 |
100 58
|
140
|
41°38'27
|
8°47'30
|
41°38'14
|
8°47'45
|
DF | |
| 2 CL 85 |
150 122
|
110
|
41°35'47
|
8°44'33
|
41°35'44
|
8°44'55
|
B | |
| 2 CL 86 |
125 110
|
110
|
41°35'42
|
8°44'55
|
41°35'40
|
8°45'12
|
DF | |
| 2 CL 87 |
128 110
|
90
|
41°35'15
|
8°44'52
|
41°35'20
|
8°45'15
|
B | |
| 2 CL 87bis |
110
|
|
41°35'18
|
8°45'05
|
|
|
B | |
| 2 CL 88 |
100 87
|
90
|
41°35'25
|
8°45'12
|
41°35'24
|
8°45'24
|
B | |
| 2 CL 88bis |
88
|
|
41°35'24
|
8°45'25
|
|
|
B | |
| 2 CL 89 |
150 122
|
|
41°42'33
|
8°38'48
|
41°42'42
|
8°38'04
|
DF- | |
| 2 CL 90 |
105 68
|
|
41°47'06
|
8°41'27
|
41°47'18
|
8°42'03
|
DF- | |
| 2 CL 91 |
142
|
40
|
41°24'18
|
8°51'00
|
41°24'24
|
8°51'11
|
B | |
| 2 CL 92 |
127 ?
|
40
|
41°24'37
|
8°51'25
|
41°24'52
|
8°51'42
|
DF | |
| 2 CL 93 |
110 118
|
70
|
41°24'42
|
8°54'30
|
41°24'45
|
8°54'40
|
DF | |
| 2 CL 94 |
130 130
|
60
|
41°20'20
|
8°56'00
|
41°20'30
|
8°56'30
|
DF | |
| 2 CL 95 |
120
|
60
|
41°20'48
|
8°57'00
|
41°20'55
|
8°57'30
|
DF- | |
| 2 CL 96 |
150 160
|
315
|
41°35'09
|
9°29'33
|
41°35'12
|
9°29'21
|
B | |
| 2 CL 97 |
150 137
|
215
|
41°35'12
|
9°29'15
|
41°35'06
|
9°28'57
|
B | |
| 2 CL 98 |
160 145
|
285
|
41°35'16
|
9°29'15
|
41°35'00
|
9°28'48
|
B | |
| 2 CL 98 |
145
|
|
41°35'09
|
9°29'05
|
|
|
B | |
| 2 CL 99 |
145
|
|
41°35'09
|
9°29'05
|
41°35'06
|
9°28'57
|
B | |
| 2 CL 100 |
145 145
|
340
|
41°35'06
|
9°28'54
|
41°35'24
|
9°28'57
|
B | |
| 2 CL 101 |
155 142
|
285
|
41°35'09
|
9°29'27
|
41°35'11
|
9°28'45
|
B | |
| 2 CL 102 |
117 113
|
275
|
41°35'00
|
9°27'53
|
41°35'06
|
9°27'27
|
DF | |
| 2 CL 103 |
124 125
|
340
|
41°32'33
|
9°29'06
|
41°32'49
|
9°29'02
|
B | |
| 2 CL 104 |
146 140
|
280
|
41°32'51
|
9°29'54
|
41°32'54
|
9°29'30
|
B | |
| 2 CL 104 |
140
|
|
41°32'54
|
9°29'30
|
|
|
B | |
| 2 CL 105 |
146 154
|
358
|
41°33'15
|
9°29'47
|
41°33'48
|
9°29'39
|
C- | |
| 2 CL 106 |
148 154
|
358
|
41°32'15
|
9°29'47
|
41°33'30
|
9°29'43
|
B | |
| 2 CL 106 |
145
|
|
41°33'30
|
9°29'43
|
|
|
B- | |
| 2 CL 107 |
150 120
|
238
|
41°43'46
|
9°26'13
|
41°43'38
|
9°25'59
|
B | |
| 2 CL 108 |
150 117
|
238
|
41°43'46
|
9°26'13
|
41°43'36
|
9°26'10
|
DF | |
| 2 CL 109 |
150 100
|
238
|
41°43'34
|
9°26'11
|
41°43'26
|
9°25'48
|
DF | |
| 2 CL 110 |
150 145
|
205
|
41°49'17
|
9°28'06
|
41°48'56
|
9°27'35
|
B | |
| 2 CL 110 |
150
|
|
41°48'45
|
9°27'36
|
|
|
B | |
| 2 CL 111 |
155 130
|
180
|
42°22'09
|
9°37'15
|
42°21'37
|
9°37'00
|
B | |
| 2 CL 111 |
128
|
|
42°21'37
|
9°37'00
|
|
|
B | |
| 2 CL 112 |
150 127
|
|
42°22'09
|
9°37'15
|
42°21'41
|
9°36'57
|
B | |
| 2 CL 112 |
146
|
|
42°22'09
|
9°37'15
|
|
|
B | |
| 2 CL 113 |
+150 ?
|
180
|
42°39'51
|
9°33'25
|
42°39'23
|
9°33'11
|
DF- | |
| 2 CL 114 |
200 150
|
150
|
42°39'19
|
9°33'06
|
42°38'55
|
9°33'22
|
B | |
| 2 CL 115 |
135 117
|
175
|
42°38'30
|
9°33'12
|
42°38'10
|
9°33'11
|
B | |
| 2 CL 116 |
150 119
|
225
|
42°38'22
|
9°33'24
|
42°38'20
|
9°32'58
|
B | |
| 2 CL 116 |
116
|
|
42°38'20
|
9°32'58
|
|
|
B | |
| 2 CL 117 |
155 137
|
|
42°37'30
|
9°35'42
|
42°37'05
|
9°35'50
|
B | |
| 2 CL 118 |
123+150
|
340
|
42°37'12
|
9°35'39
|
42°37'33
|
9°35'28
|
B | |
| 2 CL 119 |
150 ?
|
145
|
42°37'21
|
9°37'54
|
42°36'42
|
9°38'24
|
DF- | |
| 2 CL 120 |
150 ?
|
235
|
42°36'48
|
9°38'22
|
42°36'18
|
9°37'24
|
DF | |
| 2 CL 121 |
150 95
|
235
|
42°36'10
|
9°37'22
|
42°36'03
|
9°36'49
|
DF- | |
| 2 CL 122 |
69 67
|
300
|
42°36'00
|
9°36'27
|
42°36'11
|
9°36'12
|
D | |
| 2 CL 123 |
150 130
|
|
42°37'32
|
9°35'38
|
42°37'04
|
9°35'49
|
B | |
| 2 CL 123 |
156
|
|
42°37'32
|
9°35'38
|
|
|
B | |
| 2 CL 124 |
132 155
|
0
|
42°31'06
|
9°35'50
|
42°37'28
|
9°35'44
|
B | |
| 2 CL 125 |
140 128
|
160
|
42°37'19
|
9°35'29
|
42°36'58
|
9°35'45
|
B | |
| 2 CL 126 |
147 154
|
300
|
42°37'42
|
9°34'39
|
42°37'58
|
9°34'03
|
B | |
| 2 CL 126 |
155
|
|
42°37'58
|
9°34'03
|
|
|
B | |
| 2 CL 127 |
150 113
|
270
|
42°37'58
|
9°34'03
|
42°37'55
|
9°33'19
|
DF- | |
| 6 CL 128 |
200 220
|
235
|
42°40'30
|
8°44'35
|
42°40'09
|
8°44'04
|
DF- | |
| 6 CL 129 |
181 192
|
235
|
42°40'30
|
8°44'56
|
42°40'17
|
8°44'29
|
B | |
| 6 CL 130 |
166 175
|
235
|
42°40'25
|
8°45'08
|
42°40'11
|
8°44'68
|
B | |
| 6 CL 131 |
156 162
|
235
|
42°40'04
|
8°45'30
|
42°39'50
|
8°45'07
|
B | |
| 6 CL 132 |
170 253
|
235
|
42°39'20
|
8°44'28
|
42°39'04
|
8°44'08
|
B | |
| 6 CL 133 |
420 460
|
235
|
42°40'17
|
8°43'00
|
42°39'48
|
8°42'02
|
D | |
| 6 CL 134 |
325 330
|
235
|
42°38'34
|
8°39'34
|
42°38'28
|
8°39'19
|
D | |
| 6 CL 135 |
335 343
|
235
|
42°38'17
|
8°38'28
|
42°38'02
|
8°38'04
|
D- | |
| 6 CL 136 |
320 327
|
230
|
42°38'32
|
8°39'37
|
42°38'25
|
8°39'18
|
DF- | |
| 6 CL 137 |
127 118
|
230
|
42°44'17
|
9°02'05
|
42°44'07
|
9°01'48
|
B | |
| 6 CL 138 |
155 164
|
230
|
42°45'07
|
9°01'35
|
42°44'43
|
9°01'06
|
B | |
| 6 CL 138-1 |
155 163
|
230
|
42°44'58
|
9°01'33
|
42°44'43
|
9°01'04
|
B | |
| 6 CL 139 |
165 169
|
230
|
42°44'55
|
9°01'08
|
42°44'37
|
9°00'42
|
B | |
| 6 CL 140 |
310 325
|
225
|
42°45'16
|
8°59'34
|
42°45'11
|
8°59'21
|
D- | |
| 6 CL 141 |
330 340
|
225
|
42°44'59
|
8°59'00
|
42°44.83
|
8°58.78
|
D- | |
| 6 CL 142 |
345 355
|
230
|
42°45'04
|
8°59'15
|
42°45.00
|
8°58.50
|
D | |
| 6 CL 143 |
110 99
|
240
|
42°42'20
|
8°56'22
|
42°42.46
|
8°56.26
|
B | |
| 6 CL 144 |
455 350
|
225
|
42°43'27
|
8°55'31
|
42°43.24
|
8°55.32
|
D | |
| 6 CL 145 |
120 127
|
300
|
42°47'50
|
9°11'23
|
42°48.00
|
9°11.02
|
B | |
| 6 CL 146 |
170 245
|
295
|
42°47'59
|
9°11'32
|
42°48.26
|
9°11.00
|
DF- | |
| 6 CL 147 |
180 197
|
125
|
42°48'02
|
9°11'18
|
42°78.00
|
9°11.43
|
B | |
| 6 CL 148 |
163 178
|
305
|
42°48'04
|
9°11'10
|
42°48.22
|
9°10.97
|
B | |
| 6 CL 149 |
145 174
|
125
|
42°47'58
|
9°11'17
|
42°47.71
|
9°11.89
|
B | |
| 5 CL 150 |
220 161
|
95
|
42°40'32
|
8°45'08
|
42°40'34
|
8°45'43
|
B | |
| 5 CL 150 |
159
|
|
42°40'34
|
8°45'43
|
|
|
B | |
| 5 CL 151 |
180 210
|
30
|
42°40'47
|
8°45'38
|
42°41'07
|
8°46'17
|
B | |
| 5 CL 151 |
220
|
|
42°41'07
|
8°46'17
|
|
|
B | |
| 5 CL 152 |
180 146
|
120
|
42°41'00
|
8°46'18
|
42°40'48
|
8°46'55
|
B | |
| 5 CL 154-1 |
330 271
|
220
|
43°06'36
|
9°36'24
|
43°04'54
|
9°36'36
|
DF- | |
| 5 CL 154-2 |
240 208
|
290
|
43°04'36
|
9°36'30
|
43°05'12
|
9°35'42
|
B | |
| 5 CL 155 |
280 240
|
260
|
43°05'18
|
9°36'30
|
43°05'30
|
9°36'00
|
DF | |
| 5 CL 156 |
330 285
|
260
|
43°05'30
|
9°36'54
|
43°05'48
|
9°36'00
|
B | |
| 5 CL 157 |
120 111
|
260
|
|
|
43°05'54
|
9°34'30
|
B | |
| 5 CL 158 |
110 100
|
225
|
43°06'12
|
9°34'00
|
43°06'06
|
9°32'48
|
B | |
| 5 CL 159 |
130 140
|
330
|
43°07'42
|
9°34'24
|
43°08'39
|
9°34'12
|
B | |
| 5 CL 160 |
230 240
|
330
|
43°08'57
|
9°34'09
|
43°10'00
|
9°34'00
|
B | |
| 5 CL 161 |
225 150
|
330
|
43°10'00
|
9°34'00
|
43°10'45
|
9°33'27
|
B | |
| 5 CL 162 |
147 143
|
330
|
43°10'45
|
9°33'27
|
43°11'42
|
9°32'48
|
B | |
| 5 CL 163 |
290 310
|
347
|
43°12'54
|
9°33'06
|
43°13'42
|
9°32'42
|
B | |
| 5 CL 164 |
280 290
|
347
|
43°14'03
|
9°33'12
|
43°15'54
|
9°32'36
|
B | |
| 5 CL 165 |
160 160
|
6
|
42°56'18
|
9°33'00
|
42°56'57
|
9°33'27
|
B | |
| 5 CL 166 |
190 150
|
6
|
42°57'06
|
9°33'30
|
42°57'42
|
9°33'42
|
B | |
| 5 CL 166 |
154
|
|
42°57'42
|
9°33'42
|
|
|
B | |
| 5 CL 167 |
200 195
|
185
|
42°57'39
|
9°33'48
|
42°57'24
|
9°33'42
|
B | |
| 5 CL 167 |
195
|
|
42°57'24
|
9°33'42
|
|
|
B | |
| 5 CL 168 |
147 103
|
290
|
42°57'30
|
9°33'18
|
42°57'36
|
9°33'00
|
B | |
| 5 CL 169 |
220 210
|
6
|
42°58'00
|
9°34'06
|
42°58'54
|
9°33'54
|
B | |
| 5 CL 170 |
263 236
|
355
|
42°59'48
|
9°35'00
|
43°01'00
|
9°34'36
|
B | |
| 5 CL 170 |
236
|
|
43°01'30
|
9°34'42
|
|
|
B | |
| 5 CL 171 |
150 105
|
355
|
42°58'06
|
9°33'24
|
42°58'36
|
9°33'42
|
B | |
| 5 CL 171 |
120
|
|
42°58'24
|
9°33'36
|
|
|
B | |
| 5 CL 172 |
100 200
|
85
|
42°45'00
|
9°29'24
|
|
|
B | |
| 5 CL 173 |
100 190
|
80
|
42°45'21
|
9°29'45
|
42°45'26
|
9°30'15
|
DF | |
| 5 CL 174 |
100 175
|
70
|
42°45'34
|
9°30'05
|
42°46'01
|
9°30'28
|
B | |
| 5 CL 175 |
230 110
|
280
|
42°53'48
|
9°33'12
|
42°53'24
|
9°32'18
|
B | |
| 5 CL 176 |
240 110
|
320
|
42°55'48
|
9°34'12
|
42°55'54
|
9°33'36
|
B | |
| 5 CL 176 |
250 120
|
320
|
42°53'48
|
9°33'12
|
42°54'00
|
9°32'18
|
DF- | |
| 5 CL 176 |
248 110
|
320
|
42°53'48
|
9°33'12
|
42°54'00
|
9°32'18
|
DF- | |
| 5 CL 177 |
280 250
|
10
|
42°55'48
|
9°34'12
|
42°55'54
|
9°33'36
|
DF | |
| 5 CL 177 |
250
|
|
42°55'54
|
9°33'36
|
|
|
B | |
| 5 CL 178 |
320 295
|
10
|
42°55'54
|
9°34'36
|
42°56'18
|
9°32'00
|
DF | |
| 5 CL 179 |
211 160
|
10
|
42°56'36
|
9°33'36
|
42°56'24
|
9°33'36
|
B | |
| 5 CL 179 |
190
|
|
42°55'42
|
9°33'06
|
|
|
B | |
| 5 CL 180 |
130 120
|
180
|
42°56'30
|
9°33'42
|
42°55'48
|
9°33'12
|
B | |
| 5 CL 180 |
124
|
|
42°55'42
|
9°33'12
|
|
|
B | |
| 5 CL 181 |
90 120
|
90
|
42°44'43
|
9°29'18
|
42°44'28
|
9°29'47
|
B | |
| 5 CL 182 |
100 107
|
50
|
42°45'30
|
9°29'52
|
42°45'35
|
9°30'15
|
B | |
| 5 CL 182-2 |
120 105
|
10
|
42°45'35
|
9°30'15
|
42°45'47
|
9°30'19
|
B | |
| 5 CL 183 |
120 115
|
30
|
42°45'16
|
9°30'03
|
42°45'18
|
9°30'13
|
B | |
| 5 CL 184 |
160 140
|
195
|
42°45'18
|
9°30'16
|
42°44'41
|
9°29'55
|
B | |
| 5 CL 184 |
140
|
|
42°44'30
|
9°29'54
|
|
|
B | |
| 5 CL 185 |
220 195
|
225
|
42°45'30
|
9°31'20
|
42°45'00
|
9°31'30
|
DF | |
| 5 CL 185 |
195
|
|
42°45'00
|
9°31'29
|
|
|
B | |
| 5 CL 186 |
130 105
|
200
|
42°45'35
|
9°29'50
|
42°45'17
|
9°29'46
|
B | |
| 5 CL 186-2 |
140 130
|
200
|
42°43'40
|
9°30'05
|
|
|
DF | |
| 5 CL 187 |
145 150
|
205
|
42°45'34
|
9°30'23
|
42°45'08
|
9°30'07
|
B | |
| 5 CL 188 |
130 125
|
205
|
42°45'30
|
9°30'18
|
42°44'45
|
9°29'52
|
B | |
| 5 CL 189 |
130 125
|
205
|
42°45'05
|
9°30'03
|
42°44'43
|
9°29'45
|
D | |
| 5 CL 190 |
150 148
|
205
|
42°45'37
|
9°30'28
|
42°44'57
|
9°30'00
|
B | |
| 5 CL 191 |
150 120
|
120
|
42°57'45
|
9°18'20
|
42°57'23
|
9°18'52
|
B | |
| 5 CL 192 |
120 75
|
90
|
42°57'25
|
9°18'45
|
42°57'27
|
9°19'00
|
DF | |
| 5 CL 193 |
115 97
|
240
|
43°00'15
|
9°18'34
|
43°00'08
|
9°18'00
|
DF | |
| 5 CL 194 |
140 65
|
240
|
43°00'23
|
9°17'55
|
43°00'08
|
9°17'20
|
DF | |
| 5 CL 195 |
150 115
|
240
|
43°00'56
|
9°16'51
|
43°00'56
|
9°16'34
|
DF | |
| 5 CL 196 |
107 115
|
330
|
42°49'11
|
9°17'43
|
42°49'30
|
9°17'26
|
DF | |
| 5 CL 197 |
115 95
|
5
|
42°49'30
|
9°17'26
|
42°49'42
|
9°17'55
|
DF | |
| 5 CL 198 |
141 200
|
290
|
42°47'28
|
9°12'03
|
42°47'47
|
9°11'22
|
B | |
| 5 CL 199 |
250 300
|
285
|
42°47'43
|
9°12'30
|
42°47'54
|
9°12'11
|
DF | |
| 6 CL 200 |
580 620
|
310
|
42°48'03
|
9°12'23
|
42°48'27
|
9°11'48
|
D | |
| 6 CL 201 |
166 160
|
345
|
43°11'09
|
9°33'10
|
43°11'29
|
9°32'56
|
B | |
| 6 CL 202 |
140 135
|
330
|
43°11'59
|
9°32'24
|
43°12'20
|
9°32'19
|
B |
Profondeurs en mètres et coordonnées du début [D] et fin [F] de traict sur le fond. Cap en °. D* prélevement de sédiment avec la drague Charcot-Picard avec caleçon. Voir aussi Table 3bra.
BRACORS 2 : 9 au 15 avril 1984 (N/O Catherine-Laurence)
BRACORS 3 : 2 au 6 juillet 1984 (N/O Catherine-Laurence)
BRACORS 4 : 4 au 8 juillet 1985 (N/O Korotneff)
BRACORS 5 : 4 au 22 novembre 1985 (N/O Catherine-Laurence)
BRACORS 6 : 19 au 23 janvier 1987 (N/O Catherine-Laurence)
Engins de prélèvement : B = benne Shipeck ; C = petit chalut à perche (2m de large) ; D = drague Charcot-Picard avec caleçon (toile de jute) ; DF = drague Charcot-Picard (sans caleçon) avec un filet de 10mm de maille, protégé par un filet de 10 à grosse maille ; L = luge. - : indique un prélévement incomplet ou vide (avarie).
Tableau 7 : Répartition des brachiopodes (en nombre d'individus) dans les stations des campagnes BraCors (Tableau 6). Figures 9-4, 9-5, 9-6, 9-7 et 9-8. Dans certaines stations, des comptages ont été effectués sur les Gryphus selon la couleur de la coquille blanche ou verte colonisées par l'algue Ostreobium. Pour la légende complète : voir Tableau 6.
| Station | Campagne | Engins | Prof [m] | Dist [milles] | Gryphus |
Gryphus
b / v |
Terebratulina | Megerlia | Megathiris | Novocrania | Platidia | |
| CL | 1 | 1983 -1 | D | 125 125 | .35 | 25 | 1 | 1 | ||||
| CL | 1 | 1983 -1 | C | 125 125 | .20 | 40 | ||||||
| CL | 1/2 | 1984 -3 | DF | 146 150 | .40 | 36 | ||||||
| CL | 2 | 1983 -1 | C | 125 135 | 40 | 40 | 10 | 1 | ||||
| CL | 2-85 | 1985 -4 | DF | 125 130 | 61 | 28 / 33 | ||||||
| CL | 3 | 1983 -1 | C | 130 130 | 7 | 8 | 1 | |||||
| CL | 4 | 1983 -1 | C | 138 130 | 2 | 2 | 12 | 1 | 1 | |||
| CL | 6 | 1983 -1 | C | 140 135 | .22 | 3 | ||||||
| CL | 9 | 1983 -1 | C | 130 130 | .20 | 3 | ||||||
| CL | 10 | 1983 -1 | C | 130 105 | .39 | 8 | 1 | |||||
| CL | 11 | 1983 -1 | C | 130 110 | .50 | 5 | ||||||
| CL | 12 | 1983 -1 | DF | 125 105 | .24 | 20 | 1 | |||||
| CL | 13 | 1983 -1 | DF | 120 100 | .34 | 40 | 40 | 20 | 20 | |||
| CL | 13-1 | 1985 -4 | DF | 140 | 219 | 194 / 25 | 10 | 2 | 1 | |||
| CL | 13-2 | 1985 -4 | DF | 150 160 | 135 | 130 / 5 | ||||||
| CL | 13-6 | 1985 -4 | DF | 125 125 | 61 | 13 / 48 | 40 | |||||
| CL | 13-7 | 1985 -4 | DF | 110 115 | 56 | 8 / 48 | ||||||
| CL | 13-11 | 1985 -4 | DF | 120 120 | 24 | 7 / 17 | ||||||
| CL | 13-13 | 1985 -5 | DF | 140 140 | .39 | 200 | 200 / 15 | |||||
| CL | 13-14 | 1985 -5 | DF | 135 135 | .43 | 264 | 144 / 120 | |||||
| CL | 13-15 | 1985 -5 | DF | 117 | .27 | 10 | 10 | 10 | ||||
| CL | 13-16 | 1985 -5 | DF | 128 115 | .79 | 40 | 20 | 20 | 20 | |||
| CL | 13-18 | 1985 -5 | DF | 125 125 | .27 | 10 | 10 | 10 | 10 | 10 | ||
| CL | 13-19 | 1985 -5 | DF | 107 98 | .32 | 10 | 10 | 10 | 10 | 10 | ||
| CL | 13-20 | 1985 -5 | DF | 135 127 | .34 | 372 | 172 / 193 | 10 | 10 | |||
| CL | 13-21 | 1985 -5 | DF | 123 110 | .36 | 10 | 10 | 10 | 10 | |||
| CL | 14 | 1983 -1 | DF | 115 105 | .18 | 55 | 104 | 76 | 30 | 1 | ||
| CL | 14 | 1984 -3 | DF | 140 85 | .48 | 20 | 20 | 20 | 20 | 20 | ||
| CL | 15 | 1983 -1 | DF | 100 95 | .27 | 40 | 100 | 40 | 68 | |||
| CL | 15 | 1984 -3 | DF | 110 98 | .39 | 10 | 10 | 10 | ||||
| CL | 15bis | 1984 -3 | DF | 150 97 | .46 | 20 | 20 | 20 | ||||
| CL | 15b2 | 1984 -3 | DF | 155 139 | .40 | 15 | 18 | |||||
| CL | 15b3 | 1984 -3 | DF | 160 143 | .25 | 2 | ||||||
| CL | 15b4 | 1984 -3 | DF | 160 135 | .34 | 13 | 24 | 15 | 2 | |||
| CL | 15-4 | 1984 -3 | DF | 110 110 | .32 | 20 | 20 | 10 | ||||
| CL | 16 | 1983 -1 | C | 140 105 | .53 | 40 | 20 | 10 | 1 | |||
| CL | 17 | 1983 -1 | C | 130 140 | .50 | 40 | ||||||
| CL | 18 | 1983 -1 | C | 130 135 | 7.02 | 30 | 2 | 7 | ||||
| CL | 21 | 1983 -1 | DF | 93 90 | .43 | 40 | ||||||
| CL | 21 | 1984 -3 | DF | 105 105 | .23 | 4 | 32 | 24 | 24 | 7 | ||
| CL | 22 | 1983 -1 | DF | 116 125 | .41 | 40 | ||||||
| CL | 23 | 1983 -1 | C | 120 130 | .44 | 100 | 1 | |||||
| CL | 25 | 1983 -1 | C | 123 128 | .39 | 40 | 2 | 1 | ||||
| CL | 26 | 1983 -1 | C | 140 145 | .35 | 20 | 40 | 20 | 1 | 1 | 30 | |
| CL | 26 | 1984 -3 | DF | 150 150 | .42 | 90 | ||||||
| CL | 26 | 1985 -4 | DF | 135 140 | 84 | 68 / 16 | 68 | 16 | 1 | |||
| CL | 26-1 | 1985 -4 | DF | 155 160 | 8 | 6 / 2 | 6 | 2 | ||||
| CL | 27 | 1983 -1 | DF | 165 145 | .43 | 7 | ||||||
| CL | 30 | 1983 -1 | DF | 300 250 | .52 | 1 | 2 | 2 | ||||
| CL | 31 | 1983 -1 | DF | 200 120 | .24 | 100 | 100 | 100 | 100 | 100 | ||
| CL | 34' | 1983 -1 | DF | 160 140 | .32 | 40 | ||||||
| CL | 34' 1 | 1984 -3 | DF | 170 180 | .51 | 90 | ||||||
| CL | 35 | 1983 -1 | DF | 105 125 | .37 | 9 | 100 | 9 | 4 | |||
| CL | 35-1 | 1984 -3 | DF | 150 150 | .69 | 27 | ||||||
| CL | 38 | 1983 -1 | DF | 117 120 | .38 | 5 | ||||||
| CL | 39 | 1983 -1 | DF | 220 180 | .24 | 8 | 2 | 2 | ||||
| CL | 41 | 1983 -1 | DF | 125 125 | .43 | 40 | ||||||
| CL | 42 | 1983 -1 | DF | 135 123 | .60 | 40 | ||||||
| CL | 43 | 1983 -1 | DF | 145 230 | .66 | 40 | ||||||
| CL | 44 | 1983 -1 | C | ?180 136 | .35 | 23 | 7 | 20 | ||||
| CL | 46 | 1983 -1 | DF | 170 150 | .45 | 100 | 1 | |||||
| CL | 46 | 1985 -4 | DF | 150 135 | 158 | 20 / 138 | ||||||
| CL | 47 | 1983 -1 | DF | 170 143 | .64 | 40 | ||||||
| CL | 49 | 1983 -1 | DF | 150 130 | .25 | 8 | ||||||
| CL | 50 | 1983 -1 | DF | 135 120 | .29 | 6 | 4 | 2 | ||||
| CL | 52 | 1983 -1 | DF | 160 115 | .28 | 5 | 85 | 77 | 6 | 2 | ||
| CL | 53 | 1983 -1 | DF | 160 115 | .10 | 1 | ||||||
| CL | 59' | 1983 -1 | DF | 180 190 | .20 | 1 | ||||||
| CL | 60 | 1983 -1 | DF | 200 180 | .35 | 2 | 1 | |||||
| CL | 61 | 1983 -1 | DF | 140 105 | .25 | 1 | 1 | |||||
| CL | 63 | 1983 -1 | DF | 150 105 | .20 | 1 | 5 | 1 | 2 | |||
| CL | 66 | 1983 -1 | DF | 200 160 | .20 | 1 | ||||||
| CL | 68 | 1983 -1 | DF | 115 95 | .24 | 1 | ||||||
| CL | 70 | 1983 -1 | DF | 210 130 | .24 | 3 | ||||||
| CL | 72 | 1983 -1 | DF | 190 160 | .14 | 1 | 1 | 1 | ||||
| CL | 73 | 1983 -1 | DF | 125 90 | .25 | 8 | 2 | 4 | ||||
| CL | 74 | 1983 -1 | DF | 110 170 | .15 | 11 | 120 | 124 | 69 | 1 | ||
| CL | 74 | 1984 -3 | DF | 120 143 | .37 | 4 | 10 | 10 | 10 | |||
| CL | 74-1 | 1984 -3 | DF | 150 110 | .51 | 30 | ||||||
| CL | 74-2 | 1984 -3 | DF | 150 90 | .16 | 8 | 16 | 1 | ||||
| CL | 74-3 | 1984 -3 | DF | 200 180 | 12 | |||||||
| CL | 74-4 | 1984 -3 | DF | 190 160 | .29 | 3 | 4 | 4 | ||||
| CL | 80 | 1984 -2 | DF | 150 140 | .43 | 1 | 1 | |||||
| CL | 83 | 1984 -2 | DF | 123 97 | .14 | 15 | 1 | |||||
| CL | 85 | 1984 -2 | DF | 150 122 | .35 | 2 | 1 | |||||
| CL | 87 | 1984 -2 | DF | 128 110 | .25 | 4 | 24 | 22 | 1 | |||
| CL | 88 | 1984 -2 | DF | 100 87 | .13 | 13 | 8 | 1 | ||||
| CL | 91 | 1984 -2 | DF | 142 ? | .39 | 30 | ||||||
| CL | 96 | 1984 -2 | DF | 160 150 | .26 | 1 | ||||||
| CL | 97 | 1984 -2 | DF | 150 137 | .43 | 50 | ||||||
| CL | 98 | 1984 -2 | DF | 160 145 | .57 | 40 | ||||||
| CL | 99 | 1984 -2 | D | 145 145 | .10 | 15 | 1 | 20 | ||||
| CL | 100 | 1984 -2 | DF | 145 145 | .54 | 15 | ||||||
| CL | 101 | 1984 -2 | DF | 155 142 | .43 | 100 | ||||||
| CL | 103 | 1984 -2 | DF | 124 125 | .44 | 10 | ||||||
| CL | 104 | 1984 -2 | DF | 146 140 | .46 | 300 | ||||||
| CL | 106 | 1984 -2 | DF | 148 154 | .50 | 30 | ||||||
| CL | 107 | 1984 -2 | DF | 150 120 | .13 | 2 | 5 | 4 | 5 | |||
| CL | 110 | 1984 -2 | DF | +150 145 | .56 | 14 | ||||||
| CL | 111 | 1984 -2 | DF | 155 130 | .42 | <100 | ||||||
| CL | 112 | 1984 -2 | DF | 150 127 | .59 | 38 | ||||||
| CL | 114 | 1984 -2 | DF | 200 150 | .14 | 5 | ||||||
| CL | 115 | 1984 -2 | DF- | 135 117 | .25 | 1 | 2 | |||||
| CL | 116 | 1984 -2 | DF | 150 119 | .31 | 9 | 2 | |||||
| CL | 117 | 1984 -2 | DF | 155 137 | .57 | 6 | ||||||
| CL | 118 | 1984 -2 | DF | 123 150 | .25 | 14 | 11 / 3 | |||||
| CL | 123 | 1984 -2 | DF | 150 130 | .53 | 1 | ||||||
| CL | 124 | 1984 -2 | DF | 132 155 | .43 | 15 | ||||||
| CL | 125 | 1984 -2 | DF | 140 128 | .43 | 10 | 1 | |||||
| CL | 126 | 1984 -2 | DF | 147 154 | .46 | 7 | ||||||
| CL | 129 | 1987 -6 | DF | 181 192 | .31 | 218 | 210 / 0 | |||||
| CL | 130 | 1987 -6 | DF | 166 175 | .34 | 296 | 296 / 0 | |||||
| CL | 131 | 1987 -6 | DF | 156 162 | .35 | 4 | ||||||
| CL | 132 | 1987 -6 | DF | 170 253 | .25 | 69 | 69 / 0 | |||||
| CL | 137 | 1987 -6 | DF | 127 118 | .24 | 8 | 8 / 0 | 37 | 51 | 5 | 2 | |
| CL | 138 | 1987 -6 | DF | 155 164 | .38 | 582 | 491 / 91 | |||||
| CL | 138-1 | 1987 -6 | DF | 155 163 | .36 | 250 | 194 / 56 | 3 | 1 | |||
| CL | 139 | 1987 -6 | DF | 165 169 | .34 | 430 | 380 / 50 | |||||
| CL | 143 | 1987 -6 | DF | 110 99 | .37 | 15 | 13 / 2 | 12 | 3 | |||
| CL | 145 | 1987 -6 | DF | 120 127 | .25 | 35 | 30 / 5 | 2 | ||||
| CL | 147 | 1987 -6 | DF | 180 197 | .24 | 295 | ||||||
| CL | 148 | 1987 -6 | DF | 163 178 | .19 | 149 | ||||||
| CL | 149 | 1987 -6 | DF | 145 174 | .46 | 32 | 32 / 0 | |||||
| CL | 150 | 1985 –5 | DF | 220 161 | .18 | 278 | 277 / 1 | 8 | 10 | |||
| CL | 151 | 1985 –5 | DF | 180 210 | .56 | 21 | 21 / 0 | 10 | 5 | |||
| CL | 152 | 1985 –5 | DF | 180 146 | .35 | 148 | 120 / 28 | 10 | 10 | |||
| CL | 154-2 | 1985 –5 | DF | 240 208 | .41 | 33 | 33 / 0 | |||||
| CL | 156 | 1985 –5 | DF | 330 285 | .61 | 1 | 0 / 1 | |||||
| CL | 157 | 1985 –5 | DF | 120 111 | .55 | 45 | 0 / 45 | |||||
| CL | 158 | 1985 –5 | DF | 110 100 | .60 | 1 | 0 / 1 | 2 | 2 | |||
| CL | 159 | 1985 –5 | DF | 130 140 | .51 | 577 | 164 / 413 | |||||
| CL | 160 | 1985 –5 | DF | 230 240 | .72 | 5 | 5 / 0 | |||||
| CL | 161 | 1985 –5 | DF | 225 150 | .53 | 29 | 21 / 8 | |||||
| CL | 162 | 1985 –5 | DF | 147 143 | .59 | 750 | 35 / 715 | |||||
| CL | 163 | 1985 -5 | DF | 290 310 | .57 | 33 | 22 / 11 | |||||
| CL | 164 | 1985 -5 | DF | 280 310 | .77 | 47 | 47 / 0 | |||||
| CL | 165 | 1985 -5 | DF | 160 160 | .43 | 7 | 6 / 1 | |||||
| CL | 166 | 1985 -5 | DF | 190 150 | .41 | 230 | 230 / 0 | |||||
| CL | 167 | 1985 -5 | DF | 200 195 | .49 | 30 | 30 / 0 | |||||
| CL | 168 | 1985 -5 | DF | 147 103 | .31 | 19 | 5 / 14 | |||||
| CL | 169 | 1985 -5 | DF | 220 210 | .65 | 46 | 46 / 0 | |||||
| CL | 170 | 1985 -5 | DF | 263 236 | .38 | 1 | 1 / 0 | |||||
| CL | 171 | 1985 -5 | DF | 150 105 | .31 | 43 | 33 / 10 | |||||
| CL | 172 | 1985 -5 | DF | 100 200 | .62 | 27 | 27 / 0 | |||||
| CL | 174 | 1985 -5 | DF | 100 175 | .56 | 1 | 0 / 1 | |||||
| CL | 175 | 1985 -5 | DF | 230 110 | .48 | 10 | 10 / 0 | |||||
| CL | 176 | 1985 -5 | DF | 248 110 | .70 | 10 | 10 / 0 | |||||
| CL | 179 | 1985 -5 | DF | 211 160 | .19 | 93 | 93 / 0 | |||||
| CL | 180 | 1985 -5 | DF | 130 120 | .41 | 17 | 11 / 6 | |||||
| CL | 181 | 1985 -5 | DF | 90 120 | .43 | 15 | 1 / 14 | |||||
| CL | 182 | 1985 -5 | DF | 100 107 | .56 | 2 | 2 / 0 | |||||
| CL | 182-2 | 1985 -5 | DF | 120 105 | .46 | 2 | 1 / 1 | |||||
| CL | 183 | 1985 -5 | DF | 120 115 | .39 | 2 | 2 / 0 | |||||
| CL | 184 | 1985 -5 | DF | 160 140 | .63 | 52 | 52 / 0 | |||||
| CL | 186 | 1985 -5 | DF | 130 105 | .22 | 55 | 33 / 32 | |||||
| CL | 187 | 1985 -5 | D | 145 150 | .36 | 2 | 2 / 0 | |||||
| CL | 188 | 1985 -5 | DF | 130 125 | .60 | 269 | 220 / 49 | |||||
| CL | 190 | 1985 -5 | DF | 150 148 | .58 | 1 | 1 / 0 | |||||
| CL | 191 | 1985 -5 | DF | 150 120 | .43 | 1 | ||||||
| CL | 195 | 1985 -5 | DF | 150 115 | .38 | 10 | 10 | |||||
| CL | 198 | 1985 -5 | DF | 141 200 | .57 | 248 | 248 / 0 | |||||
| CL | 201 | 1987 -6 | DF | 166 160 | .28 | 10 | 10 / 0 | |||||
| CL | 202 | 1987 -6 | DF | 140 135 | .24 | 15 | 10 / 5 | 5 | 5 | 3 | 10 | |
Tableau 8 : Campagne BathyMed (CNRS ; chef de mission : Christian C. Emig), du 7 au 22 novembre 1988 (N/O Catherine-Laurence). Figures 9-4, 9-5 et 9-6.
Profondeurs en mètres et coordonnées du début [D] et fin [F] de traict.
Engins de prélèvement : B = benne Shipeck ; C = petit chalut à perche (2m de large) ; D = drague Charcot-Picard avec caleçon (toile de jute) ; DF = drague Charcot-Picard (sans caleçon) avec un filet de 10mm de maille, protégé par un filet de 10 à grosse maille ; L = luge. - : indique un prélévement incomplet ou vide (avarie).
| Campagne et Stations |
Profondeur [D - F] |
cap | Latitude N [D] | Longitude E [D] | Latitude N [F] | Longitude E [F] | Engin | Transect | Brachiopoda | |
| BM 1 | 200 | 180 | 60 | 42°45.00 | 9°01.04 | 42°45.38 | 9°02.15' |
D-
|
C4 | |
| BM 2 | 220 | 220 | 240 | 42°45.71 | 9°02.64 | 42°45.44 | 9°02.21 |
D-
|
C4 | |
| BM 3 | 200 | 186 | 230 | 42°45.46 | 9°02.14 | 42°45.22 | 9°01.56 |
DF
|
C4 | B |
| BM 4 | 200 | 200 | 42°45.20 | 9°01.31 |
B
|
C4 | ||||
| BM 5 | 200 | 200 | 230 | 42°45.70 | 9°02.69 | 42°45.41 | 9°02.07 |
D
|
C4 | |
| BM 6 | 173 | 199 | 230 | 42°45.30 | 9°01.87 | 42°45.25 | 9°01.55 |
L
|
C4 | |
| BM 7 | 155 | 156 | 255 | 42°45.20 | 9°01.86 | 42°45.12 | 9°01.50 |
DF
|
C4 | B |
| BM 8 | 155 | 155 | 42°45.12 | 9°01.50 |
B
|
C4 | ||||
| BM 8' | 155 | 155 | 42°45.12 | 9°01.50 |
B
|
C4 | ||||
| BM 9 | 146 | 168 | 255 | 42°45.17 | 9°01.92 | 42°45.13 | 9°01.40 |
DJ
|
C4 | |
| BM 10 | 149 | 164 | 255 | 42°45.30 | 9°02.16 | 42°45.13 | 9°01.41 |
C-
|
C4 | |
| BM 11 | 150 | 159 | 255 | 42°45.18 | 9°01.91 | 45°44.81 | 9°00.88 |
C
|
C4 | B |
| BM 12 | 146 | 145 | 42°45.00 | 9°02.19 | 45°44.71 | 9°01.80 |
DF-
|
C4 | ||
| BM 13 | 147 | 144 | 42°44.98 | 9°02.15 | 42°44.68 | 9°01.80 |
DF
|
C4 | B | |
| BM 14 | 141 | 140 | 230 | 42°44.88 | 9°02.16 | 42°44.61 | 9°01.78 |
DJ
|
C4 | |
| BM 15 | 139 | 139 | 42°44.61 | 9°01.81 | 42°44.58 | 9°01.76 |
B
|
C4 | ||
| BM 15' | 140 | 141 | 42°44.56 | 9°01.64 | 42°44.55 | 9°01.63 |
B
|
C4 | ||
| BM 16 | 460 | 457 | 230 | 42°46.65 | 9°00.99 | 42°46.30 | 9°00.34 |
D
|
C4 | |
| BM 17 | 464 | 464 | 42°46.69 | 9°01.18 | 42°46.71 | 9°01.20 |
B-
|
C4 | ||
| BM 18 | 463 | 442 | 42°46.69 | 9°01.18 | 42°46.08 | 8°59.70 |
L
|
C4 | ||
| BM 19 | 143 | 141 | 42°45.03 | 9°02.34 | 42°44.62 | 9°01.76 |
DF-
|
C4 | B | |
| BM 20 | 137 | 123 | 42°44.51 | 9°01.64 | 42°43.88 | 9°01.32 |
DF
|
C4 | B | |
| BM 21 | 119 | 115 | 42°44.28 | 9°01.84 | 42°43.94 | 9°01.41 |
D-
|
C4 | ||
| BM 22 | 115 | 115 | 42°44.61 | 9°02.23 |
D-
|
C4 | B | |||
| BM 23 | 117 | 118 | 210 | 42°44.76 | 9°02.73 | 42°44.59 | 9°02.41 |
DF
|
C4 | B |
| BM 24 | 114 | 122 | 42°44.65 | 9°02.29 |
B-
|
C4 | ||||
| BM 25 | 135 | 133 | 42°44.88 | 9°02.34 | 42°44.06 | 9°01.47 |
L
|
C4 | ||
| BM 26 | 132 | 128 | 42°41.31 | 8°48.86 | 42°41.20 | 8°48.47 |
DF
|
C3 | B | |
| BM 27 | 128 | 132 | 42°41.17 | 8°48.43 | 42°41.01 | 8°47.93 |
DF
|
C3 | B | |
| BM 28 | 143 | 136 | 42°41.56 | 8°48.47 | 42°41.51 | 8°48.14 |
DF
|
C3 | B | |
| BM 29 | 149 | 142 | 42°41.57 | 8°48.70 | 42°41.59 | 8°48.09 |
DF
|
C3 | B | |
| BM 30 | 147 | 139 | 250 | 42°41.67 | 8°48.11 | 42°41.60 | 8°47.61 |
DF
|
C3 | B |
| BM 31 | 124 | 122 | 230 | 42°39.26 | 8°47.45 | 42°38.95 | 8°47.32 |
DF
|
C2 | B |
| BM 32 | 124 | 122 | 230 | 42°39.54 | 8°47.10 | 42°39.34 | 9°46.78 |
DF
|
C2 | B |
| BM 33 | 130 | 128 | 42°39.62 | 8°46.72 | 42°39.21 | 8°46.25 |
DF
|
C2 | B | |
| BM 34 | 126 | 126 | 42°39.15 | 8°46.27 |
B
|
C2 | ||||
| BM 35 | 133 | 129 | 42°39.31 | 8°46.12 | 42°38.97 | 8°45.87 |
DJ
|
C2 | ||
| BM 36 | 131 | 129 | 220 | 42°39.77 | 8°46.75 | 42°39.09 | 8°45.95 |
L
|
C2 | |
| BM 37 | 143 | 141 | 42°39.84 | 8°45.94 | 42°39.48 | 8°45.55 |
DF
|
C2 | B | |
| BM 38 | 150 | 152 | 42°39.62 | 8°45.25 | 42°39.28 | 8°44.88 |
DF
|
C2 | B | |
| BM 39 | 164 | 165 | 230 | 42°40.57 | 8°45.19 | 42°40.20 | 8°44.79 |
DF
|
C2 | B |
| BM 40 | 181 | 176 | 230 | 42°42.37 | 8°44.47 | 42°40.03 | 8°44.21 |
D
|
C2 | B |
| BM 41 | 176 | 177 | 220 | 42°40.47 | 8°44.71 | 42°39.87 | 8°44.05 |
L
|
C2 | |
| BM 42 | 176 | 176 | 42°39.81 | 8°44.05 |
B-
|
C2 | ||||
| BM 43 | 175 | 175 | 42°39.80 | 8°44.08 |
B-
|
C2 | ||||
| BM 44 | 175 | 175 | 42°39.75 | 8°44.12 |
B-
|
C2 | ||||
| BM 45 | 174 | 176 | 42°40.32 | 8°44.66 | 42°39.80 | 8°44.07 |
C
|
C2 | B | |
| BM 46 | 197 | 192 | 220 | 42°40.24 | 8°44.09 | 42°39.90 | 8°43.74 |
DF
|
C2 | B |
| BM 47 | 231 | 238 | 220 | 42°40.39 | 8°43.78 | 42°40.27 | 8°43.44 |
DF-
|
C2 | |
| BM 48 | 231 | 224 | 220 | 42°40.47 | 8°43.85 | 42°40.03 | 8°43.50 |
DF
|
C2 | B |
| BM 49 | 231 | 238 | 40 | 42°40.19 | 8°43.52 | 42°40.81 | 8°44.54 |
D
|
C2 | |
| BM 50 | 230 | 230 | 42°40.85 | 8°44.87 |
B
|
C2 | ||||
| BM 51 | 175 | 175 | 42°39.77 | 8°44.07 |
B
|
C3 | ||||
| BM 52 | 420 | 460 | 42°40.37 | 8°42.93 | 42°41.38 | 8°44.58 |
D-
|
C3 | ||
| BM 53 | 473 | 471 | 70 | 42°41.50 | 8°45.48 | 42°42.16 | 8°47.18 |
J-
|
C3 | |
| BM 54 | 450 | 465 | 240 | 42°42.28 | 8°47.53 | 42°41.91 | 8°46.36 |
L-
|
C3 | |
| BM 55 | 434 | 468 | 250 | 42°42.00 | 8°46.70 | 42°41.67 | 8°45.93 |
D
|
C3 | |
| BM 56 | 368 | 420 | 42°41.95 | 8°46.97 | 42°42.11 | 8°48.12 |
D-
|
C3 | ||
| BM 57 | 448 | 448 | 42°42.22 | 8°48.37 |
B
|
C3 | ||||
| BM 57' | 448 | 448 | 42°42.22 | 8°48.37 |
B
|
C3 | ||||
| BM 58 | 150 | 162 | 260 | 42°41.62 | 8°48.35 | 42°41.78 | 8°47.71 |
DF
|
C3 | B |
| BM 59 | 170 | 188 | 42°41.78 | 8°47.65 | 42°41.73 | 8°47.09 |
DF
|
C3 | B | |
| BM 60 | 214 | 250 | 42°41.79 | 8°47.51 | 42°41.76 | 8°48.39 |
DF
|
C3 | B | |
| BM 61 | 345 | 373 | 240 | 42°41.92 | 8°47.20 | 42°41.79 | 8°46.41 |
DF
|
C3 | B |
| BM 62 | 350 | 350 | 42°41.90 | 8°46.95 |
B
|
C3 | ||||
| BM 63 | 230 | 230 | 42°41.79 | 8°47.39 |
B
|
C3 | ||||
| BM 64 | 171 | 171 | 42°41.78 | 8°47.71 |
B
|
C3 | ||||
| BM 64' | 170 | 170 | 42°41.78 | 8°47.70 |
B
|
C3 | ||||
| BM 65 | 145 | 145 | 42°41.62 | 8°48.19 |
B-
|
C3 | ||||
| BM 66 | 148 | 148 | 42°41.58 | 8°48.22 |
B-
|
C3 | B | |||
| BM 67 | 210 | 212 | 10 | 42°56.55 | 9°33.62 | 42°57.10 | 9°33.73 |
DF
|
C6 S | B |
| BM 68 | 234 | 237 | 190 | 42°57.07 | 9°33.99 | 42°56.43 | 9°33.78 |
DF
|
C6 S | B |
| BM 69 | 234 | 234 | 10 | 42°56.47 | 9°33.75 | 42°56.97 | 9°33.99 |
D
|
C6 S | |
| BM 70 | 303 | 310 | 190 | 42°56.80 | 9°35.83 | 42°56.12 | 9°35.46 |
D
|
C6 S | |
| BM 71 | 382 | 390 | 10 | 42°55.34 | 9°40.07 | 42°56.87 | 9°40.34 |
D
|
C6 S | |
| BM 72 | 392 | 392 | 42°57.01 | 9°40.48 |
B
|
C6 S | ||||
| BM 73 | 303 | 303 | 42°56.80 | 9°35.86 |
B
|
C6 S | ||||
| BM 74 | 230 | 230 | 42°57.08 | 9°33.97 |
B
|
C6 S | ||||
| BM 75 | 180 | 180 | 42°46.94 | 9°33.44 |
B
|
C6 S | ||||
| BM 76 | 182 | 196 | 190 | 42°57.46 | 9°33.55 | 42°56.76 | 9°33.48 |
DF
|
C6 S | B |
| BM 77 | 160 | 172 | 10 | 42°56.97 | 9°33.41 | 42°57.68 | 9°33.49 |
DF
|
C6 S | B |
| BM 78 | 163 | 170 | 190 | 42°57.72 | 9°33.49 | 42°57.13 | 9°33.45 |
D
|
C6 S | B |
| BM 79 | 142 | 146 | 10 | 42°57.29 | 9°33.35 | 42°57.74 | 9°33.44 |
DF-
|
C6 S | |
| BM 80 | 142 | 146 | 190 | 42°57.76 | 9°33.43 | 42°57.14 | 9°33.36 |
DF
|
C6 S | B |
| BM 81 | 128 | 134 | 10 | 42°57.20 | 9°33.31 | 42°57.66 | 9°33.37 |
DF
|
C6 S | B |
| BM 82 | 148 | 146 | 190 | 42°57.43 | 9°33.36 | 42°56.27 | 9°33.12 |
C
|
C6 S | B |
| BM 83 | 125 | 122 | 10 | 42°56.40 | 9°33.14 | 42°57.03 | 9°33.26 |
DF
|
C6 S | B |
| BM 84 | 111 | 105 | 190 | 42°57.01 | 9°33.18 | 42°56.39 | 9°32.78 |
DF
|
C6 S | B |
| BM 85 | 106 | 106 | 42°56.40 | 9°32.77 |
B
|
C6 S | ||||
| BM 86 | 136 | 136 | 42°57.68 | 9°33.40 |
B
|
C6 S | ||||
| BM 87 | 116 | 108 | 10 | 42°57.69 | 9°33.32 | 42°58.38 | 9°33.41 |
DF
|
C6 S | |
| BM 88 | 152 | 150 | 350 | 43°12.05 | 9°32.53 | 43°12.93 | 9°32.22 |
DF
|
C6 N | B |
| BM 89 | 182 | 190 | 170 | 43°12.98 | 9°32.37 | 43°12.36 | 9°32.58 |
DF
|
C6 N | B |
| BM 90 | 215 | 233 | 350 | 43°12.44 | 9°32.66 | 43°13.23 | 9°32.35 |
DF
|
C6 N | B |
| BM 91 | 278 | 290 | 170 | 43°13.20 | 9°32.64 | 43°12.33 | 9°33.06 |
DF
|
C6 N | B |
| BM 92 | 340 | 353 | 350 | 43°12.37 | 9°33.68 | 43°13.57 | 9°33.26 |
D
|
C6 N | |
| BM 93 | 410 | 410 | 186 | 43°14.08 | 9°35.57 | 43°13.34 | 9°35.49 |
D
|
C6 N | |
| BM 94 | 410 | 410 | 43°13.34 | 9°35.52 |
B
|
C6 N | ||||
| BM 95 | 350 | 350 | 43°13.34 | 9°33.22 |
B
|
C6 N | ||||
| BM 96 | 314 | 320 | 43°13.31 | 9°32.89 | 43°12.36 | 9°33.42 |
B
|
C6 N | ||
| BM 97 | 232 | 232 | 43°12.26 | 9°32.74 |
B
|
C6 N | ||||
| BM 98 | 154 | 154 | 43°12.31 | 9°32.49 |
B
|
C6 N | ||||
| BM 99 | 173 | 248 | 170 | 43°12.12 | 9°32.56 | 43°10.88 | 9°33.18 |
C
|
C6 N | B |
Tableau 9 : Répartition des brachiopodes (en nombre d'individus) dans les stations de la campagne BathyMed (Tableau 8). Figures 9-4, 9-5 et 9-6. Dans certaines stations, des comptages ont été éffectués sur les Gryphus selon la couleur de la coquille blanche ou verte colonisées par l'algue Ostreobium. Pour la légende complète : voir Tableau 8.
|
Campagne et Stations |
Profondeur [ D - F ] |
Dist [milles] | Transect | Gryphus |
Gryphus
b / v |
Terebratulina | Megerlia | Megathiris | Novocrania | Platidia | |
| BM 3 D | 200 | 186 | C4 | 36 | 36/0 | 3 | |||||
| BM 7 D | 155 | 156 | C4 | 11 | 11/0 | 19 | 1 | 1 | |||
| BM 11 C | 150 | 159 | C4 | 421 | 302/119 | ||||||
| BM 13 D | 147 | 144 | C4 | 7 | 6/1 | ||||||
| BM 19 D | 143 | 141 | C4 | 10 | 10/0 | 1 | |||||
| BM 20 D | 137 | 123 | 0,49 | C4 | 3 | 1/2 | |||||
| BM 22 DJ | 115 | 115 | C4 | 1 | 8 | 15 | 7 | 1 | |||
| BM 23 D | 117 | 118 | 0,25 | C4 | 8 | 6/2 | 25 | 11 | 2 | ||
| BM 26 D | 132 | 128 | 0,24 | C3 | 14 | 4 | 11 | 2 | |||
| BM 27 D | 128 | 132 | 0,36 | C3 | 138 | 8/130 | 2 | 1 | 1 | ||
| BM 28 D | 143 | 136 | 0,24 | C3 | 16 | 16/0 | 29 | 7 | 2 | 3 | |
| BM 29 D | 149 | 142 | 0,37 | C3 | 5 | 13 | 2 | ||||
| BM 30 D | 147 | 139 | 0,35 | C3 | 2 | 21 | 41 | 36 | |||
| BM 31 D | 124 | 122 | 0,20 | C2 | 3 | 3 | |||||
| BM 32 D | 124 | 122 | 0,21 | C2 | 2 | 5 | 2 | ||||
| BM 33 D | 130 | 128 | 0,44 | C2 | 29 | 5/24 | |||||
| BM 37 D | 143 | 141 | 0,36 | C2 | 9 | 1/8 | |||||
| BM 38 D | 150 | 152 | 0,39 | C2 | 7 | 6/1 | |||||
| BM 39 D | 164 | 165 | 0,41 | C2 | 166 | 155/11 | |||||
| BM 40 DJ | 181 | 176 | 0,35 | C2 | 21 | 19/2 | |||||
| BM 45 C | 174 | 176 | 0,68 | C2 | 441 | 424/17 | |||||
| BM 46 D | 197 | 192 | 0,38 | C2 | 92 | 92/0 | |||||
| BM 48 D | 231 | 224 | 0,56 | C2 | 2 | 2/0 | |||||
| BM 58 D | 150 | 162 | 0,47 | C3 | 5 | 7 | 1 | 4 | |||
| BM 59 D | 170 | 188 | 0,39 | C3 | 13 | 11 | 26 | ||||
| BM 60 D | 214 | 250 | 0,44 | C3 | 32 | 32/0 | 25 | 6 | 1 | 1 | |
| BM 61 D | 345 | 373 | 0,67 | C3 | 2 | 2/0 | |||||
| BM 66 B | 148 | 148 | C3 | 1 | 10 | 3 | |||||
| BM 67 D | 210 | 212 | 0,46 | C6 S | 76 | 75/1 | |||||
| BM 68 D | 234 | 237 | 0,41 | C6 S | 12 | 12/0 | |||||
| BM 76 D | 182 | 196 | 0,49 | C6 S | 74 | 74/0 | |||||
| BM 77 D | 160 | 172 | 0,62 | C6 S | 28 | 28/0 | |||||
| BM 78 DJ | 163 | 170 | 0,34 | C6 S | 5 | 5/0 | |||||
| BM 80 D | 142 | 146 | 0,33 | C6 S | 43 | 39/4 | |||||
| BM 81 D | 128 | 134 | 0,43 | C6 S | 7 | 7/0 | |||||
| BM 82 C | 148 | 146 | 0,76 | C6 S | 351 | 260/91 | |||||
| BM 83 D | 125 | 122 | 0,55 | C6 S | 15 | 14/1 | |||||
| BM 84 D | 111 | 105 | 0,42 | C6 S | 24 | 10/14 | |||||
| BM 88 D | 152 | 150 | 0,57 | C6 N | 56 | 5/51 | |||||
| BM 89 D | 182 | 190 | 0,56 | C6 N | 18 | 11/7 | 1 | ||||
| BM 90 D | 215 | 233 | 0,53 | C6 N | 12 | 11/1 | |||||
| BM 91 D | 278 | 290 | 0,77 | C6 N | 32 | 32/0 | |||||
| BM 99 C | 173 | 248 | 0,83 | C6 N | 374 | 231/143 | |||||
Tableau 10 : Campagnes Meditis 2-4 (IFREMER) avec le N/O Europe. Elles ont eu lieu en mai ou juin entre 2012 et 2014; seules les stations avec brachiopodes ont été listées. Figures 9-4 et 9-7.
[D] sont les données lors de la mise à l'eau du chalut ; [F] au moment de la remontée du chalut. Distance du traict en mètres, sa durée en minutes et le nombre de Gryphus récoltés avec un chalut.
| Année | Station |
Latitude N [D]
|
Longitude E [D]
|
Prof [m] [D] |
Latitude N [F]
|
Longitude E [F]
|
Prof [m] [F] |
Durée [min] | Distance [m] | Gryphus |
|
2012
|
2-7 | 42°14,22' | 9°37,70' | 110 | 42°15,65' | 9°38,38' | 108 | 30 | 2815 | 141 |
|
2012
|
2-10 | 41°56,60' | 9°33,73' | 142 | 41°55,48' | 9°32,49' | 130 | 30 | 2685 | 4237 |
|
2012
|
2-13 | 42°21,20' | 9°39,47' | 318 | 42°24,25' | 9°40,28' | 361 | 60 | 5759 | 5 |
|
2012
|
2-15 | 42°34,75' | 9°40,78' | 337 | 42°37,32' | 9°39,67' | 365 | 54 | 5000 | 1 |
|
2012
|
2-16 | 42°22,35' | 9°37,16' | 113 | 42°20,83' | 9°37,14' | 112 | 31 | 2833 | 374 |
|
2012
|
2-20 | 41°35,21' | 9°31,98' | 383 | 41°32,34' | 9°33,22' | 376 | 60 | 4777 | 15 |
|
2012
|
2-21 | 41°28,46' | 9°28,53' | 92 | 41°29,82' | 9°27,61' | 88 | 30 | 2815 | 1 |
|
2012
|
2-22 | 41°38,54' | 9°27,64' | 106 | 41°37,11' | 9°28,32' | 117 | 30 | 2796 | 506 |
|
2012
|
2-23 | 41°36,91' | 9°32,05' | 479 | 41°34,34' | 9°34,21' | 482 | 60 | 5630 | 17 |
|
2012
|
2-80 | 42°52,28' | 4°40,17' | 330 | 42°50,33' | 4°43,17' | 313 | 61 | 5556 | 35 |
|
2013
|
3-2 | 42°28,11' | 9°37,38' | 89 | 42°26,64' | 9°37,19' | 77 | 30 | 2741 | 6 |
|
2013
|
3-5 | 42°20,95' | 9°37,19' | 112 | 42°22,49' | 9°37,16' | 110 | 29 | 2852 | 2894 |
|
2013
|
3-11 | 41°32,17' | 9°33,21' | 377 | 41°35,02' | 9°32,09' | 370 | 60 | 5519 | 42 |
|
2013
|
3-13 | 41°36,79' | 9°28,43' | 114 | 41°38,15' | 9°27,78' | 105 | 30 | 2667 | 5219 |
|
2013
|
3-15 | 41°46,04' | 9°28,92' | 479 | 41°48,58' | 9°31,26' | 493 | 60 | 5704 | 41 |
|
2013
|
3-19 | 41°56,77' | 9°33,91' | 143 | 41°55,54' | 9°32,64' | 129 | 29 | 2852 | 2391 |
|
2013
|
3-20 | 42°14,30' | 9°37,73' | 106 | 42°15,71' | 9°38,35' | 106 | 29 | 2760 | 23 |
|
2013
|
3-35 | 42°47,13' | 3°54,31' | 350 | 42°44,07' | 3°55,19' | 478 | 60 | 5815 | 1 |
|
2013
|
3-75 | 42°52,33' | 4°39,62' | 158 | 42°50,89' | 4°41,92' | 269 | 60 | 5574 | 94 |
|
2013
|
3-76 | 42°49,12' | 4°41,75' | 345 | 42°46,13' | 4°43,38' | 760 | 60 | 6000 | 3 |
|
2014
|
4-3 | 42°40,96' | 9°34,40' | 300 | 42°38,34' | 9°36,49' | 268 | 60 | 5667 | 3 |
|
2014
|
4-6 | 42°14,76' | 9°38,00' | 110 | 42°16,18' | 9°38,43' | 106 | 30 | 2759 | 19 |
|
2014
|
4-9 | 41°37,42' | 9°31,40' | 448 | 41°34,96' | 9°33,79' | 484 | 60 | 5556 | 51 |
|
2014
|
4-10 | 41°37,19' | 9°28,21' | 114 | 41°38,59' | 9°27,57' | 105 | 30 | 2741 | 1 |
|
2014
|
4-12 | 41°47,37' | 9°30,06' | 460 | 41°44,81' | 9°27,81' | 351 | 60 | 5667 | 36 |
|
2014
|
4-13 | 41°57,17' | 9°37,14' | 446 | 41°54,14' | 9°36,52' | 554 | 60 | 5667 | 7 |
|
2014
|
4-16 | 41°57,17' | 9°34,34' | 151 | 41°56,01' | 9°33,03' | 135 | 31 | 2797 | 2106 |
|
2014
|
4-19 | 42°22,50' | 9°37,12' | 111 | 42°20,86' | 9°37,14' | 112 | 30 | 3037 | 517 |
|
2014
|
4-21 | 41°58,53' | 9°37,78' | 440 | 42°01,22' | 9°39,48' | 386 | 61 | 5500 | 4 |
|
2014
|
4-69 | 42°35,69' | 4°13,25' | 750 | 42°32,90' | 4°12,20' | 897 | 60 | 5371 | 1 |
|
2014
|
4-75 | 42°52,36' | 4°40,13' | 272 | 42°50,30' | 4°43,08' | 315 | 60 | 5556 | 52 |
9. Cartes
A. Cartes des campagnes en Languedoc et Provence
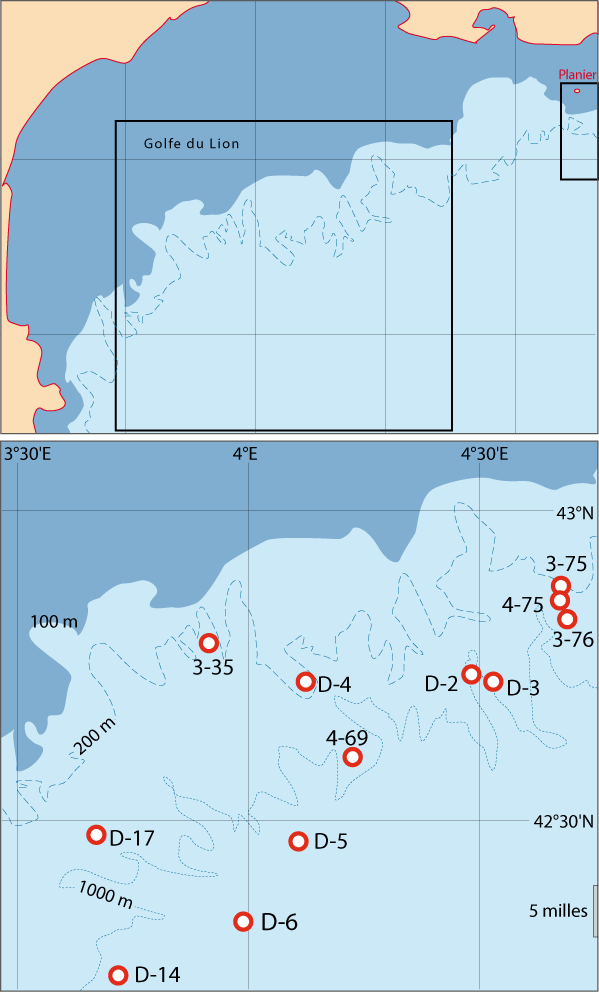
Figure 9-1 : Golfe du Lion. Localisation de la zone de récolte - et - Stations de récolte de Gryphus vitreus lors de la campagne Deprog. Voir Tableau 5.
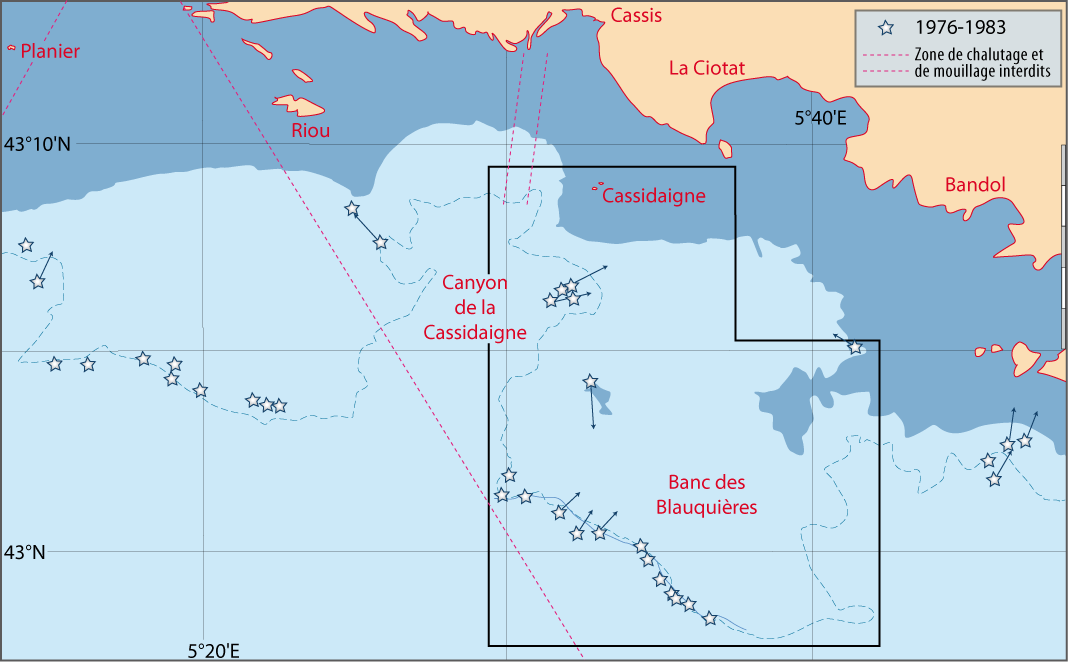
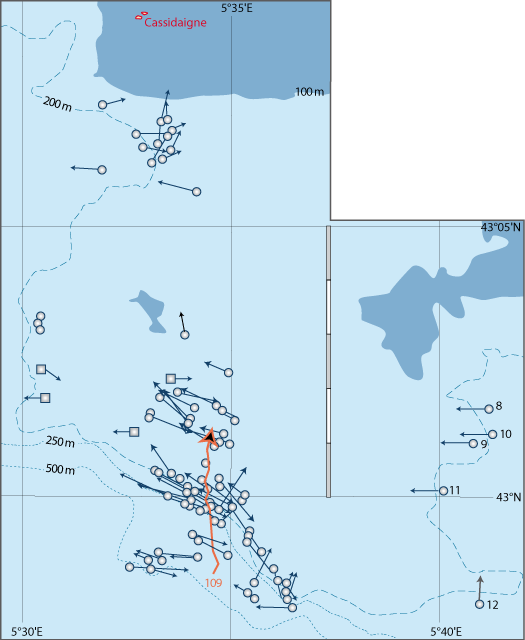
Figure 9-2 : Provence Ouest. Localisation des zones de récolte. Les étoiles indiquent les stations de prospection sur les brachiopodes entre 1976 et 1983 - et - Stations des campagnes BraProv (CNRS) et IsoBra (CNRS). Voir Tableaux 3 et 5.
Ci-dessous les cartes de distribution de Novocrania anomala. - Gryphus vitreus. - Megathiris detruncata. - Terebratulina retusa. - Platidia anomioides. - Megerlia truncata. Voir Tableaux 4 et 5.
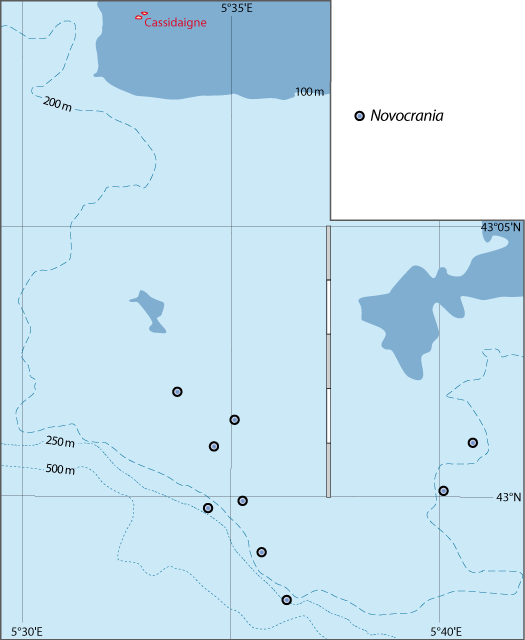
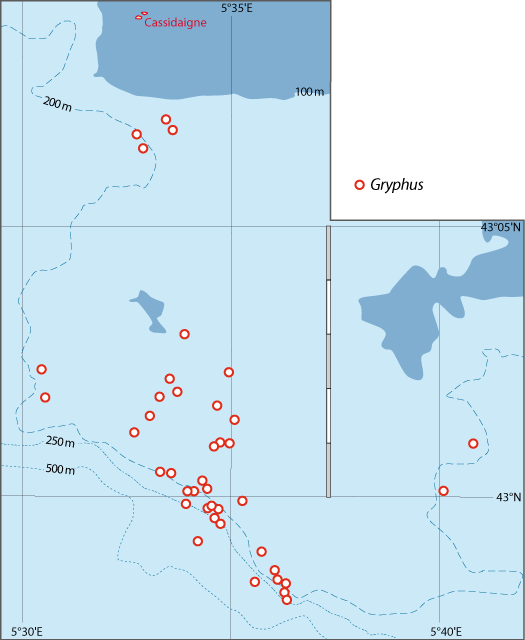
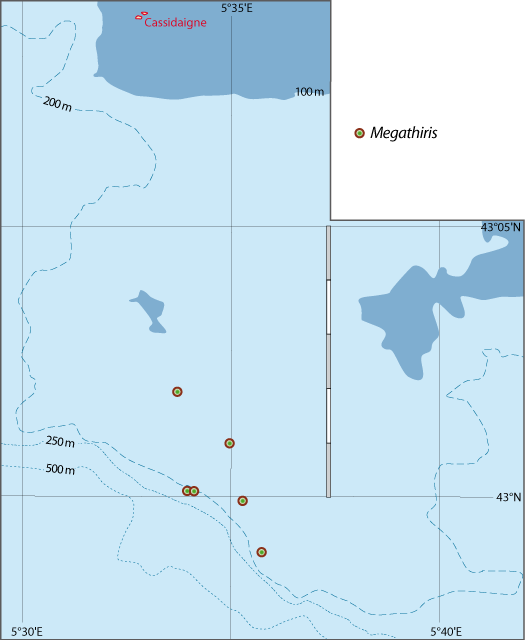
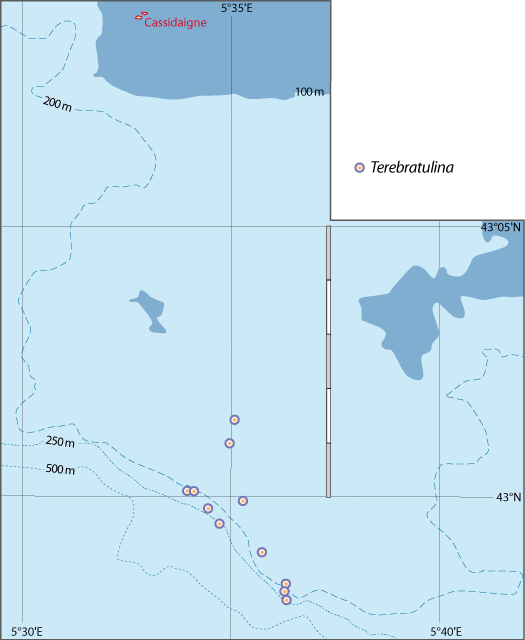
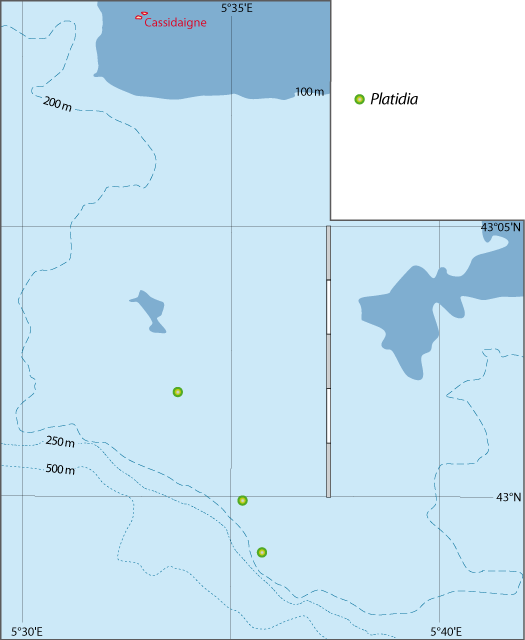
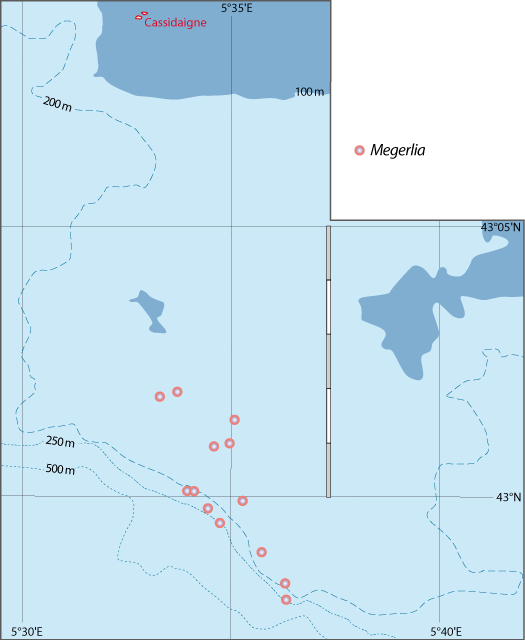
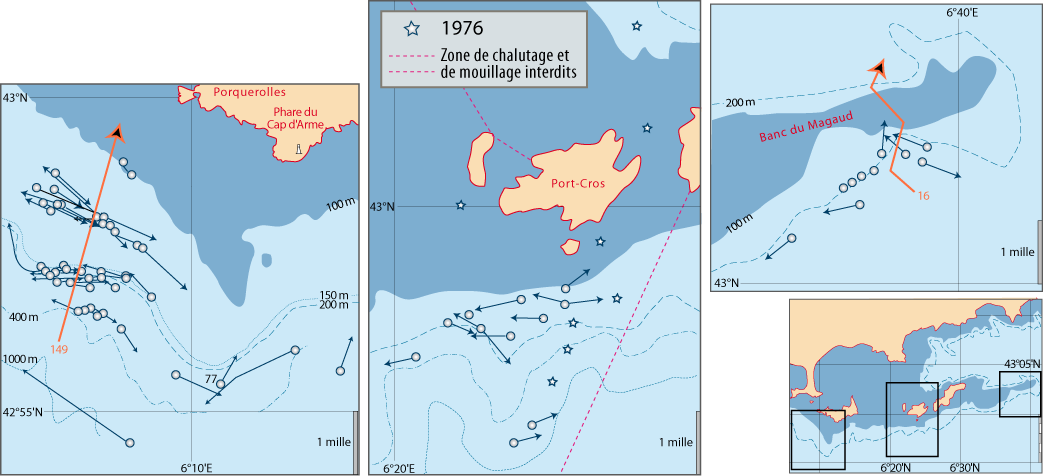
Figure 9-3 : Provence Est. Localisation des zones de récolte et des stations de campagnes BraProv (CNRS). Voir Tableau 3. Les étoiles indiquent les stations de prospection sur les brachiopodes en 1976 lors d’une campagne avec le N/O Antedon dans la Parc national marin de Port-Cros. Cette zone comprend deux des radiales (flèches) suivies par submersible.
Ci-dessous, les cartes de distribution de Novocrania anomala. - Megathiris detruncata. - Platidia anomioides. Gryphus vitreus. - Terebratulina retusa. - Megerlia truncata. Voir Tableau 4.

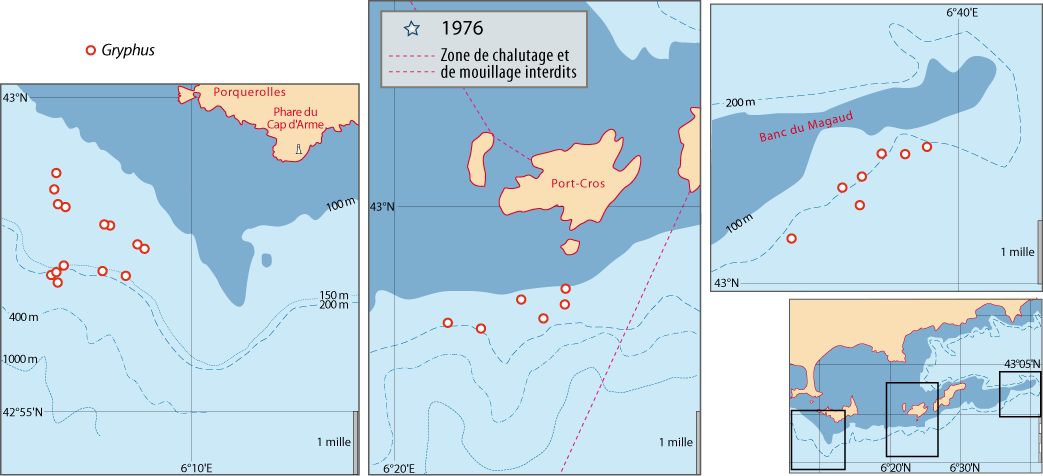
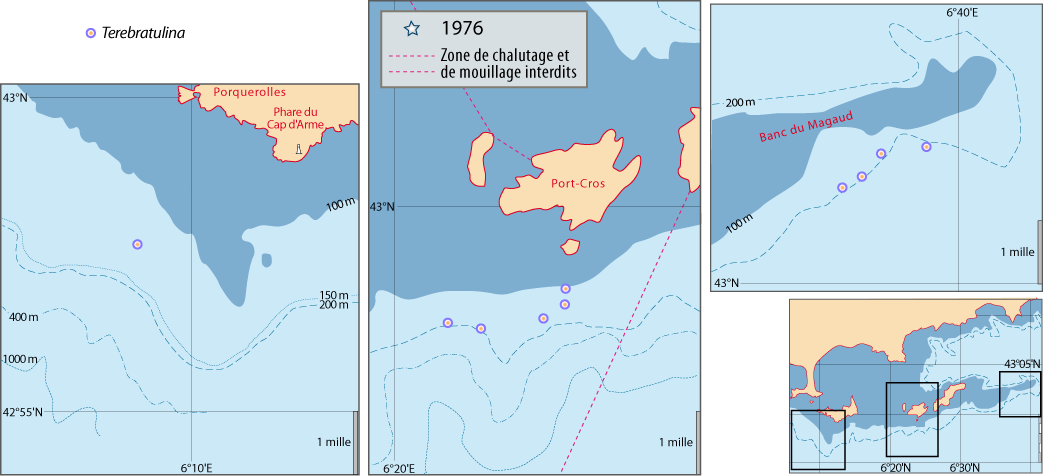
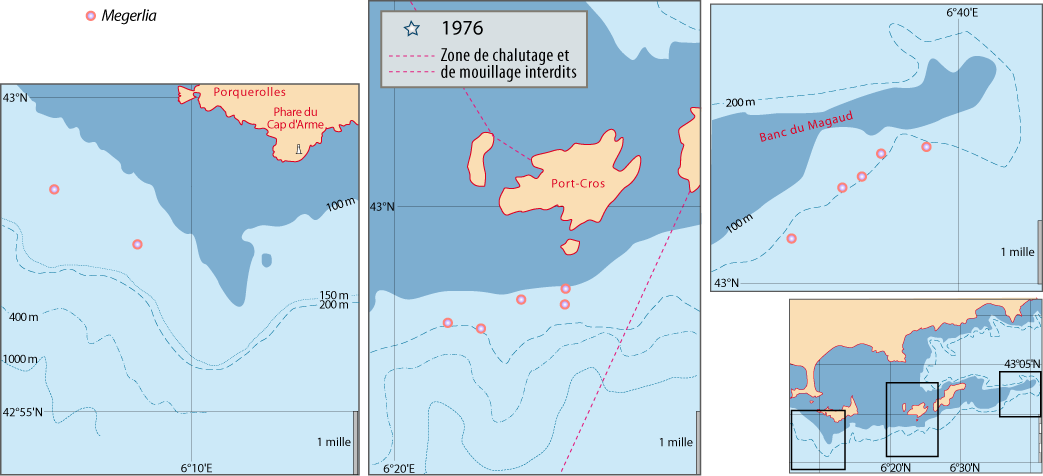
B. Cartes des campagnes en Corse
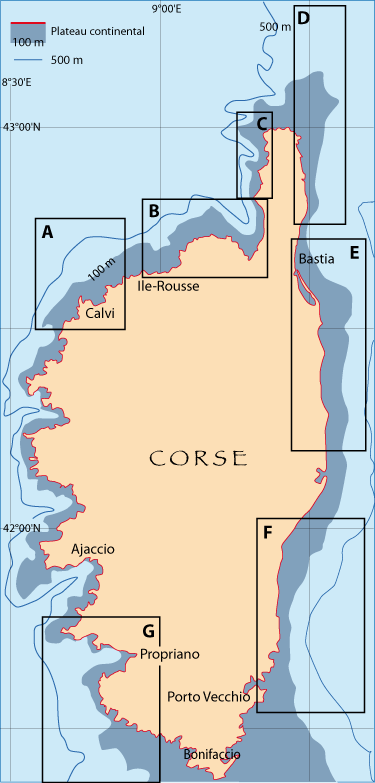
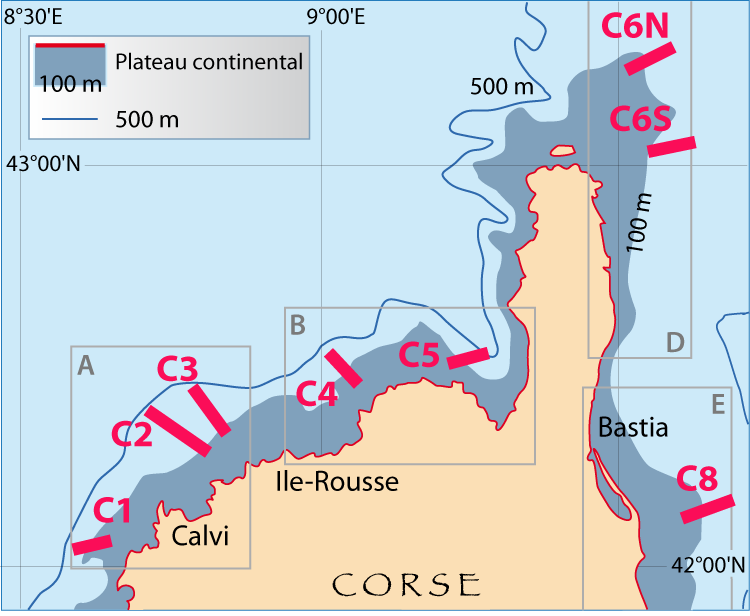
Figure 9-4 : Campagnes en Corse :
À gauche - Localisation des zones de récoltes (A à G) au cours des campagnes BraCors (CNRS), BathyMed (CNRS) et Meditis (Ifremer). Voir Tableaux 6, 8, 10.
À droite - Les radiales qui ont été suivies sur plusieurs années. Voir chapitre 6.
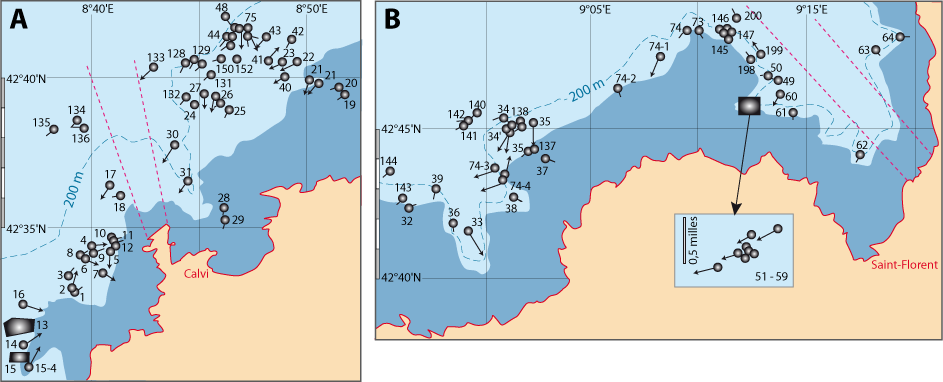
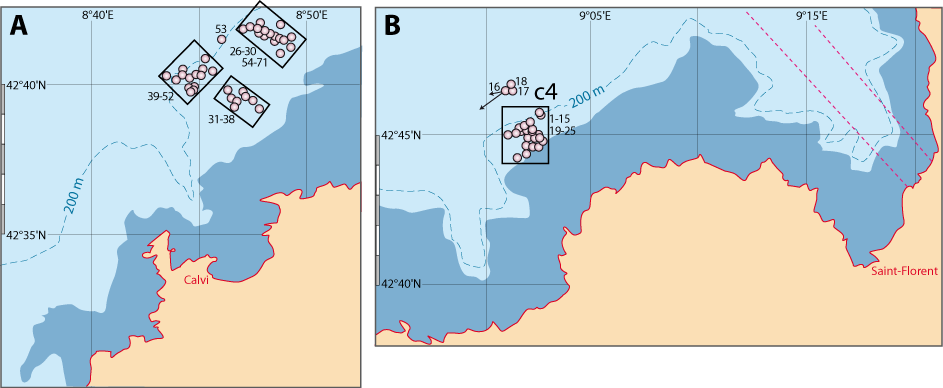
Figure 9-5 : Corse Nord-Ouest : zones A et B.
Cartes du haut : localisation des stations des campagnes BraCors (CNRS).
Carte du bas : localisation des stations de la campagne BathyMed (CNRS).
Ci-dessous, les cartes de distribution de Novocrania anomala. - Gryphus vitreus. - Terebratulina retusa. - Megathiris detruncata. - Platidia anomioides. - Megerlia truncata. Voir Tableaux 7, 9, 10.
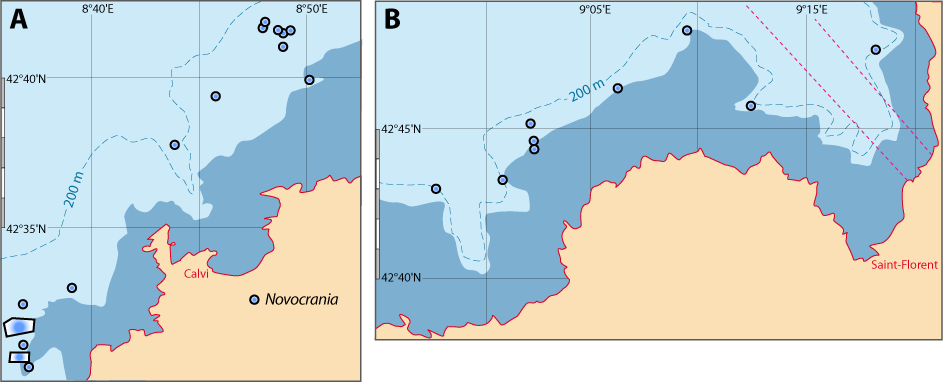
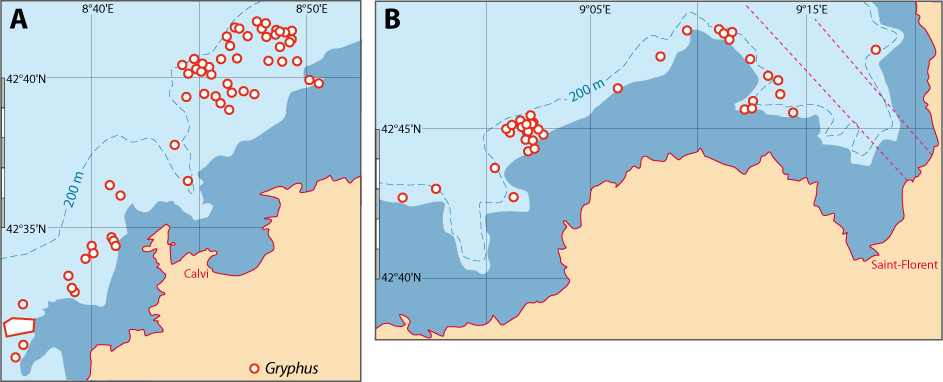
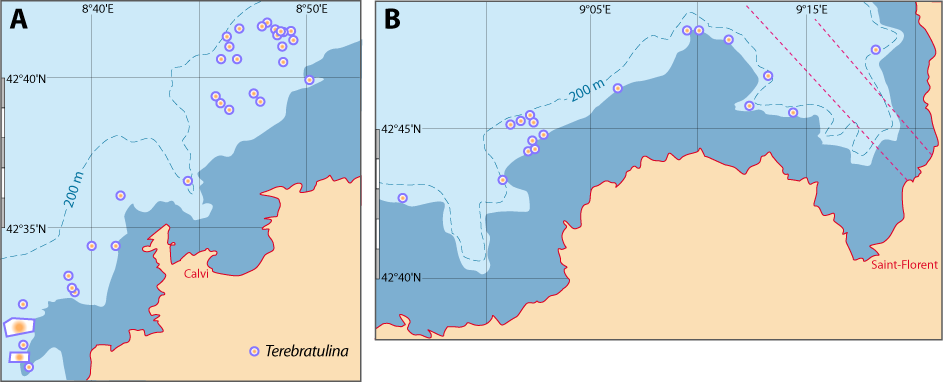
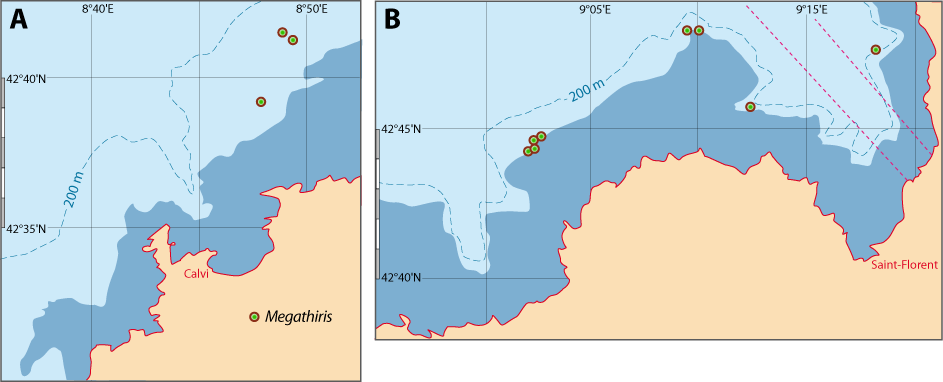
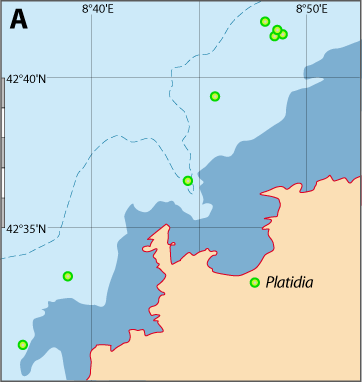
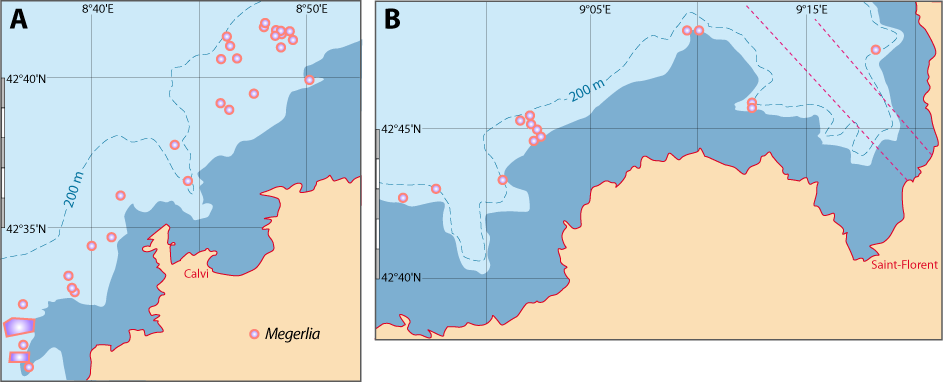
 *
* 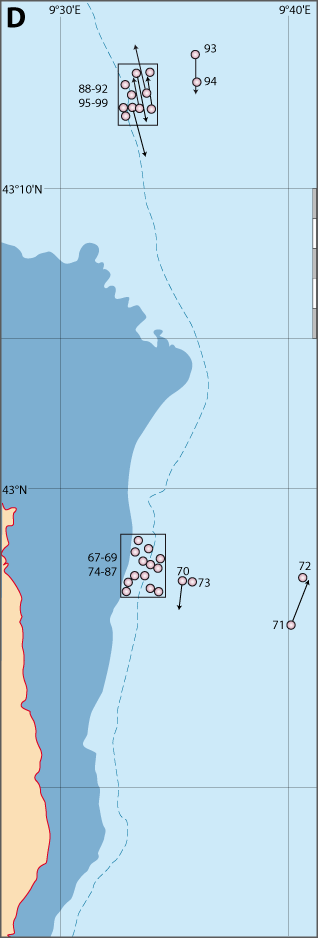
Figure 9-6 : Corse Nord : zones C et D. Localisation des stations de campagnes BraCors (CNRS) et BathyMed (CNRS). Voir Tableaux 6 et 8.
Ci-dessous, les cartes de distribution de Novocrania anomala. - Gryphus vitreus. - Terebratulina retusa. - Megathiris detruncata. - Megerlia truncata. Voir Tableaux 7 et 9.
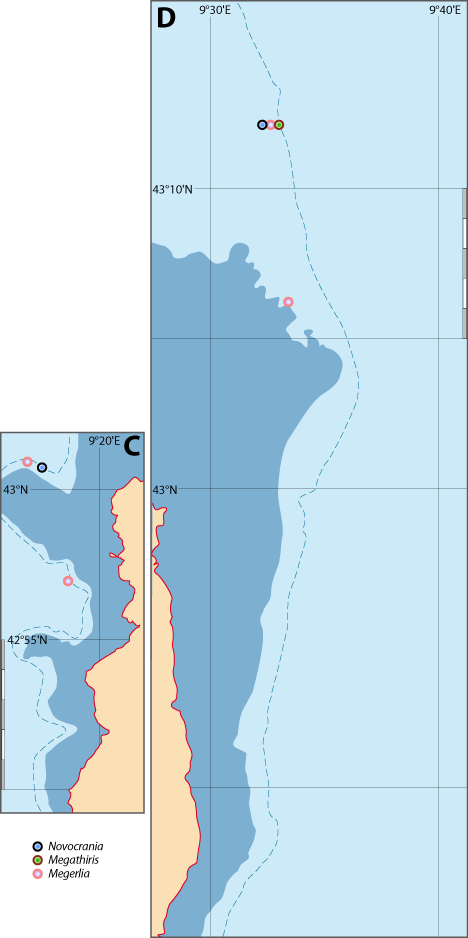
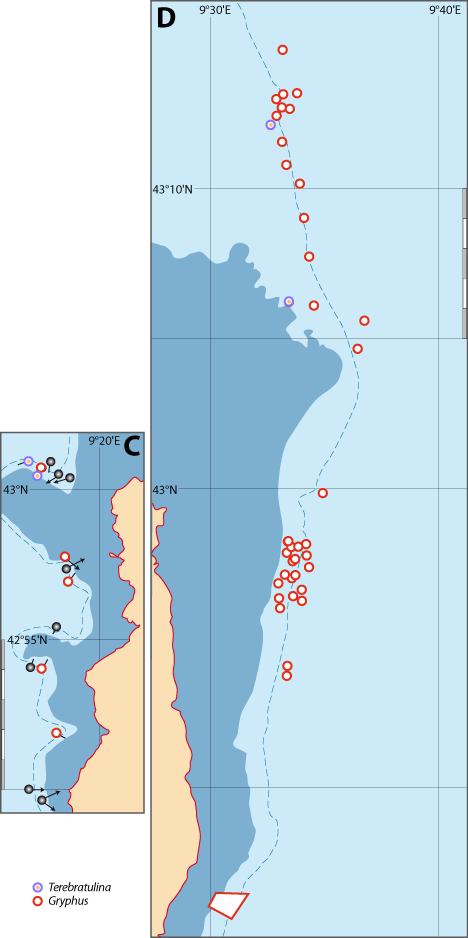
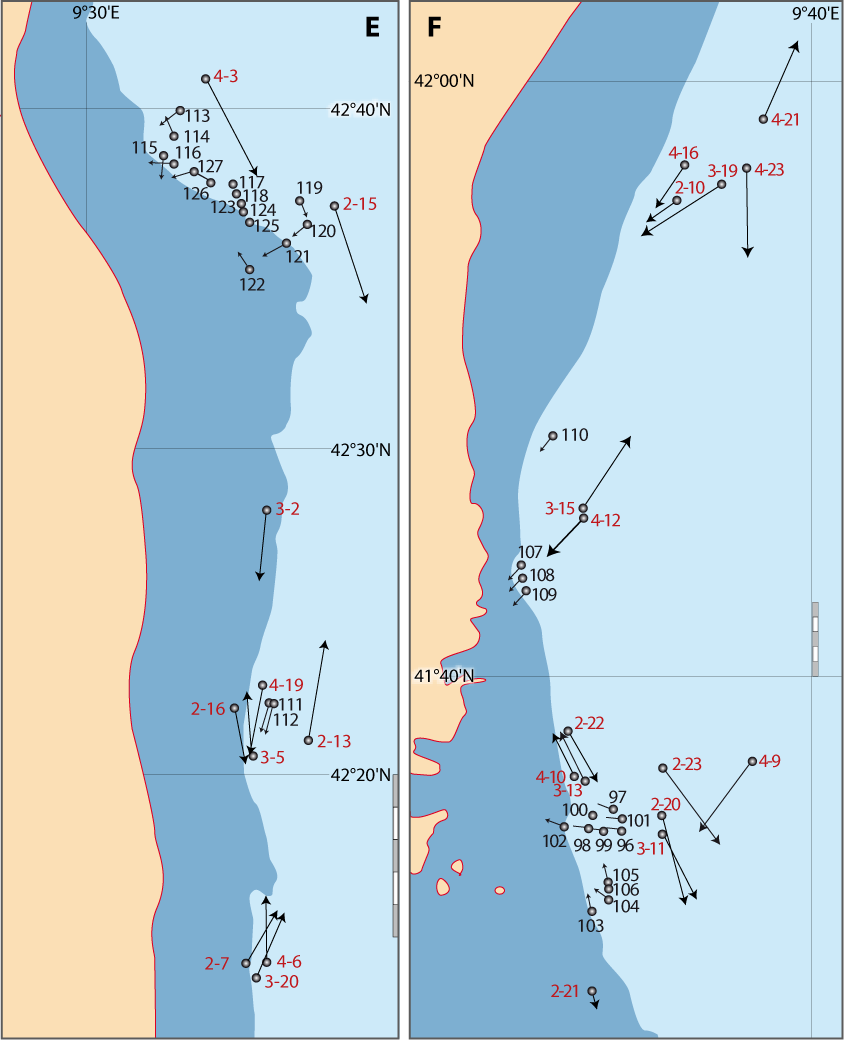
Figure 9-7 : Corse Est : zones E et F. Localisation des stations de campagnes BraCors (CNRS) – numérotées en noir - et Meditis (Ifremer) – numérotées en rouge. Voir Tableaux 6 et 10.
Ci-dessous, les cartes de distribution de Novocrania anomala. - Terebratulina retusa. - Megathiris detruncata. - Megerlia truncata. - Gryphus vitreus. Voir Tableaux 7 et 10.
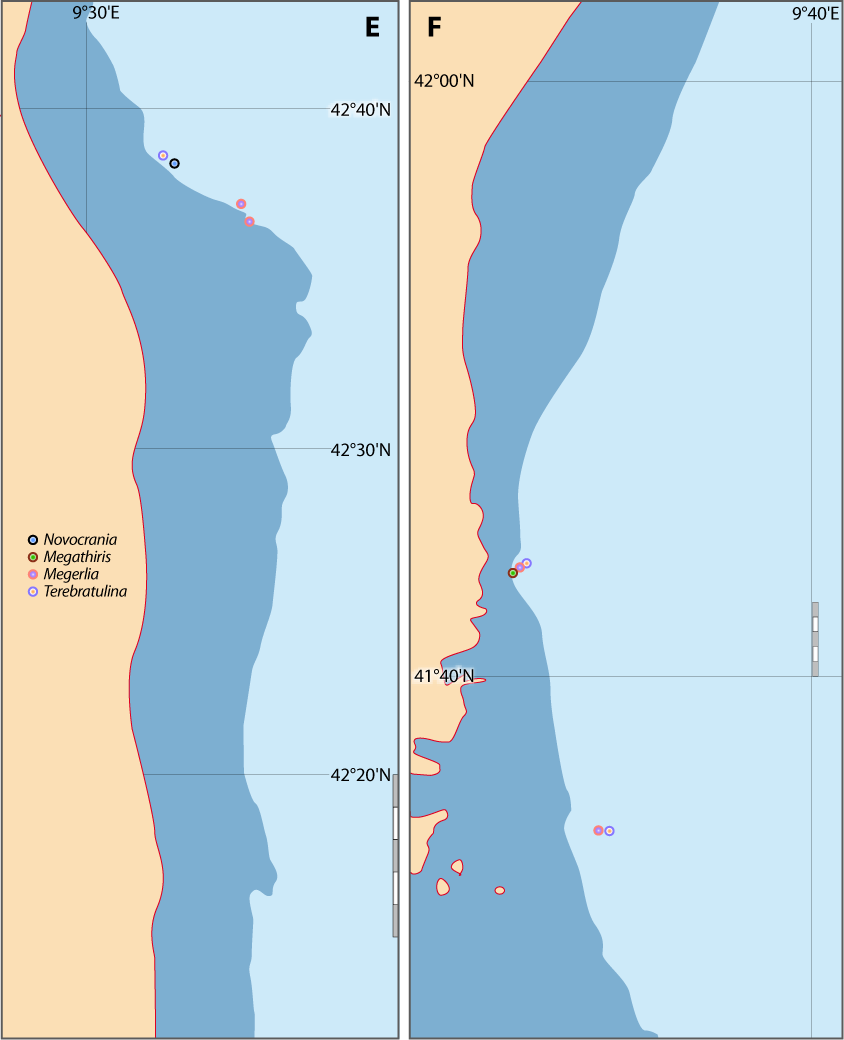
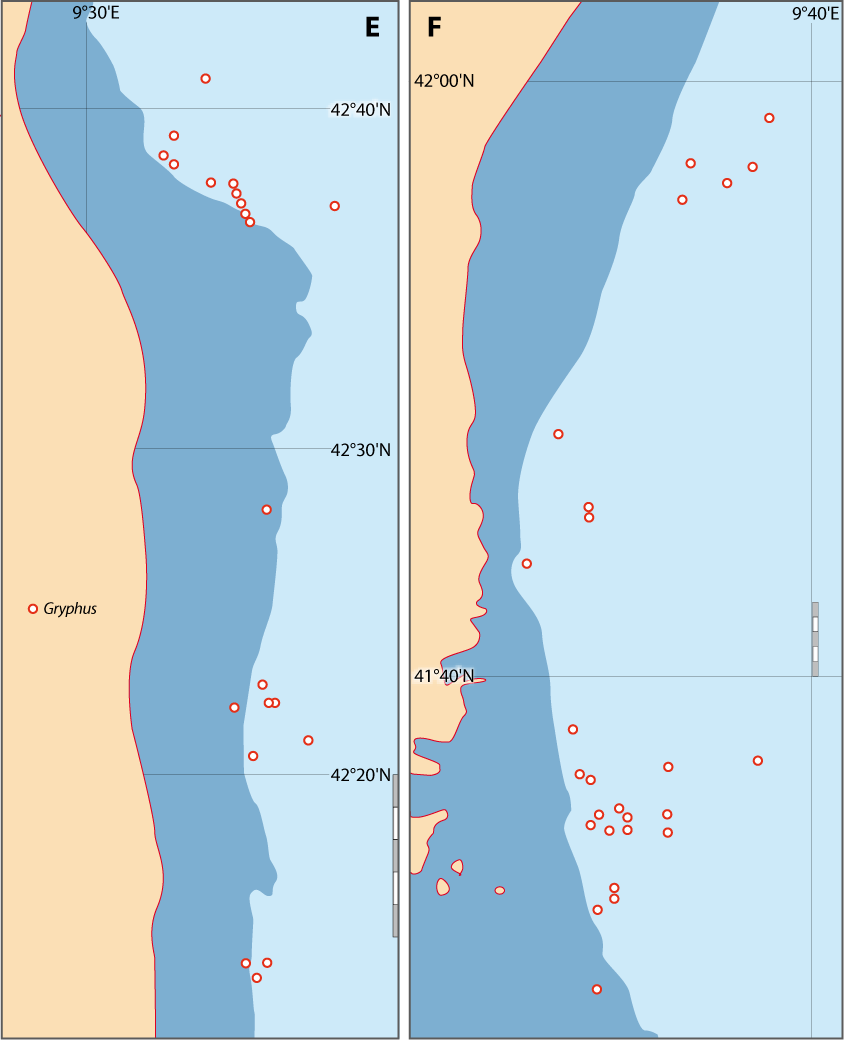
Figure 9-8 : Corse Sud : zone G. Localisation des stations de campagnes BraCors (CNRS). Voir Tableau 6.
Ci-dessous, les cartes de distribution de Novocrania anomala. - Terebratulina retusa. - Megathiris detruncata. - Megerlia truncata. - Gryphus vitreus. Voir Tableau 7.
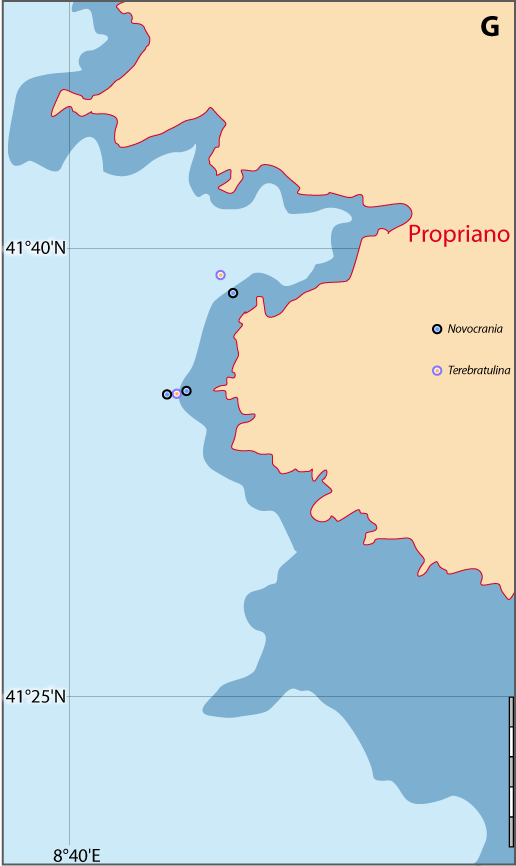
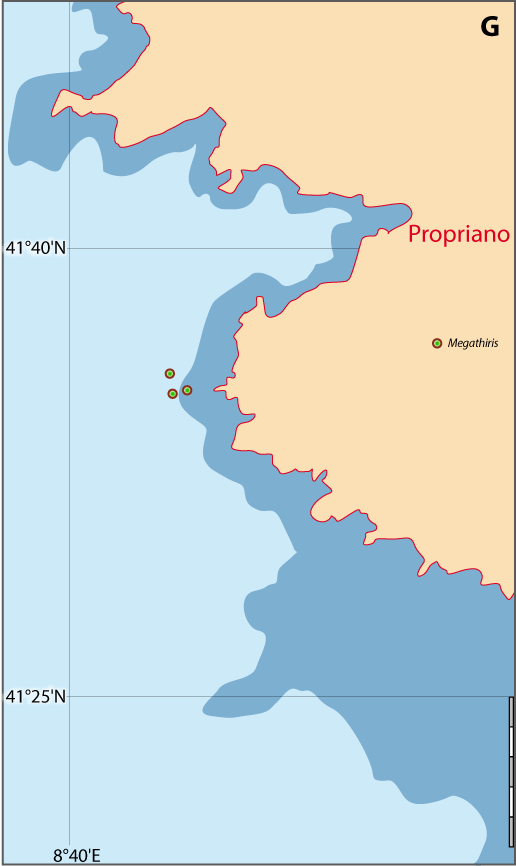
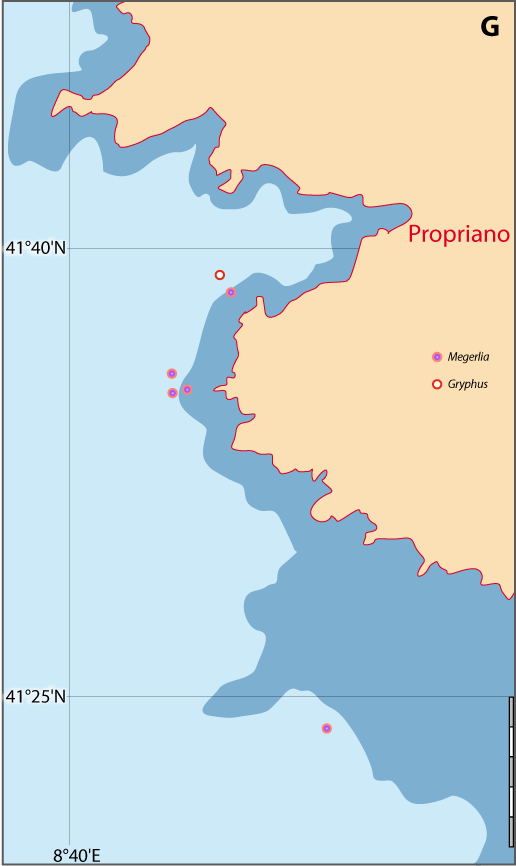
C. Cartes de distribution en Atlantique et Manche
Aux cartes marines (ci-dessus en A et B) avec les résultats des campagnes rapportées dans ce travail, il apparaît judicieux de compléter ces données en reproduisant les cartes de répartition géographique des six espèces de brachiopodes le long des côtes françaises métropolitaines dans l’océan Atlantique et la Manche, d’après les cartes publiées par Emig (2016, 2017a).
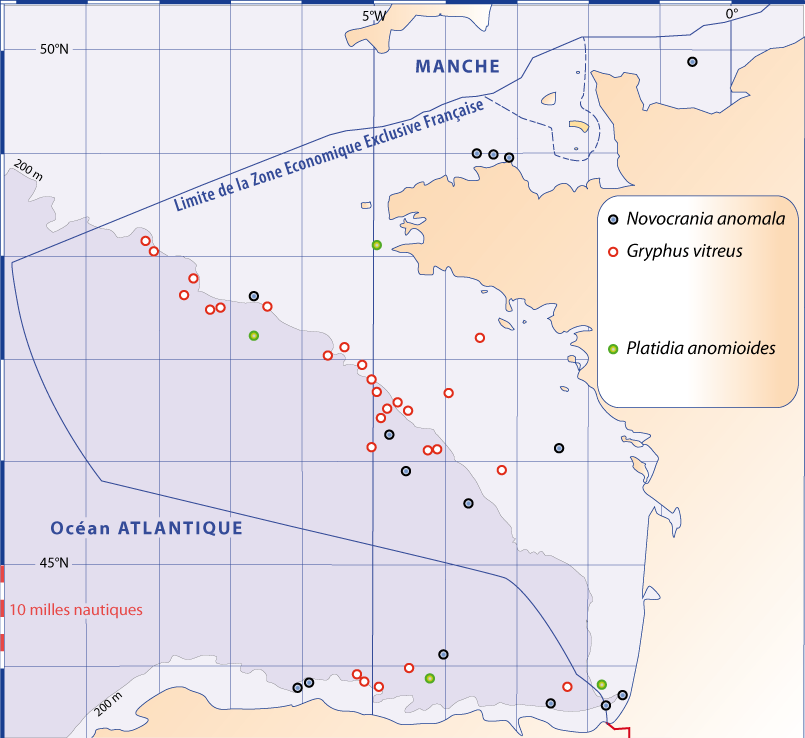 | 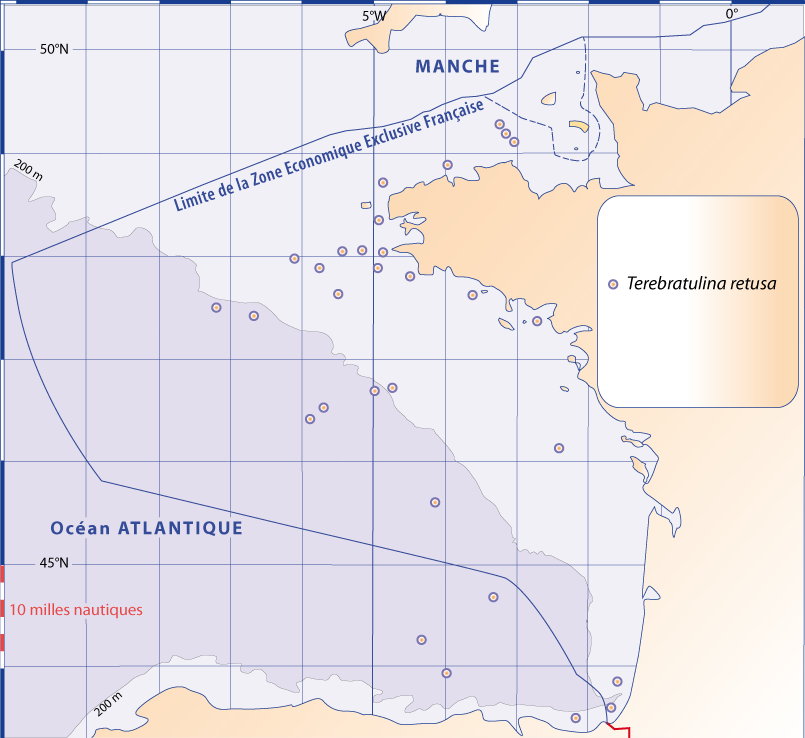 |
Figure 9-9 : Répartition géographique des six espèces de brachiopodes au large des côtes françaises métropolitaines en Atlantique et Manche (modifié, d'après Emig, 2016, 2017a).
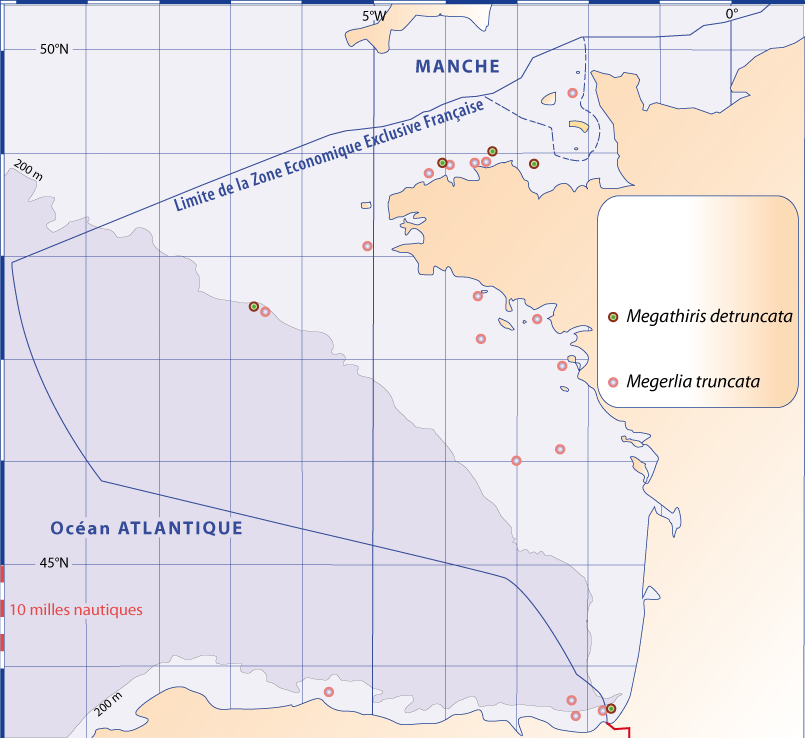
Remerciements
Je voudrais adresser tous mes remerciements à tous les marins avec lesquels j’ai navigué sur divers océans et mers. Et bien sûr, j’ai une pensée émue à tous les marins et leurs capitaines des navires du CNRS : ceux de Marseille, le N/O Antedon sur lequel j’ai commencé ma carrière et appris avec eux et Jacques Picard le travail en mer, le N/O Antedon 2 sur lequel j’ai fait ma dernier mission océanographique en mer, le N/O Alciope ; ceux de Villefranche-sur-mer le N/O Catherine-Laurence et le N/O Korotneff. Que de moments de partage, de vie en commun, de plaisir et de bonheur, aussi de labeur et de gros temps... une vraie vie de marin ! Et transmettre toutes mes amitiés à tous les collègues qui ont participé aux campagnes en mer de la RCP n°728, et en particulier à tous les membres du programe, parmi lesquels Fernando Àlvarez (Oviedo), Jean-Henri Delance (Dijon), Italo Di Geronimo (Catania), Bernard Laurin (Dijon), Jean Revert (Pau).

À bord du N/O Catherine-Laurence durant une campagne BRACORS, de gauche à droite : Italo Di Geronimo, Bernard Laurin, Christian Emig, Jean-Henri Delance, Jean Revert.
Mes remerciements aussi à Jocelyne Martin (Ifremer, Nantes) et à Angélique Jadaud (Ifremer, Sète) pour m’avoir communiquer les données sur les brachiopodes des campagnes Ifremer, citées dans ce travail.
Le Commandant en chef pour la Méditerranée et Préfet maritime de la Méditerranée (Marine Nationale) m’a toujours accordé les autorisations pour pouvoir travailler dans certaines zones interdites à tous dragages et surtout a accédé à mes demandes de plongée en submersible nommé SMI (sous-Marin d’Intervention de la Marine Nationale) Griffon, qu’il en soit chaleureusement remercié. Trois plongées ont été effectuées, les pilotes furent le Lieutenant de Vaisseau Roque, les Enseignes de Vaisseau 1e Classe Gomez et Arnoult. C’est avec ce dernier que nous avons plongé jusqu’à 600 m de profondeur, la limite autorisée et rarement atteinte par le « Griffon », aussi c’est avec une attention particulière que le mécanicien à bord a surveillé toute possible intrusion d’eau ! Mes remerciements aussi à l’aide fourni par Paul-Henri Nargeolet dans l’équipement du submersible par le Groupe d'intervention sous la mer (GISMER) de la Marine Nationale.
Enfin, mes meilleurs souvenirs à mes amis Aleksandra Bitner (Varsovie) et Fernando Álvarez (Oviedo) pour leur aide et commentaires dans la réalisation de ce livre, qu'ils en soient cordialement remerciés.
10. Références bibliographiques
Albertelli G., Della Croce N. & Fraschetti S. (1991). Benthos della plattaforma continentale ligure (Chiavari): trasversale - Luglio 1989. Rapporto technico dell’Univiversità degli di Studi di Genova, Istituto di Scienze ambientali marine, 37, 1-11.
Albertelli G. & Fraschetti S. (1992). Observations on the structure if three different communities of the continental shelf in the Ligurian Sea. Atti del IX Congresso Associazione Italiana di Oceanologia e Limnologia, p. 351-362.
Álvarez F., Alonso-Zarazaga M.A. & Emig C.C. (2005). Apéndice 2. Nomenclatura: Lista de sinónimos y combinaciones filo Braquiópoda. In : Fauna Ibérica, Museo Nacional de Ciencias Naturales, CSIC, Madrid, 27, 215-226.
Álvarez F. & Brunton C.H.C. (2008). On the realibility of reconstructing and comparing brachiopod interiors and their morphological variations based solely on serial sections. Proceedings of the Royal Society of Victoria, 120 (1), 58-74.
Álvarez F. & Emig C.C. (2005). Filo Brachiopoda. In : Fauna Ibérica, Museo de Ciencias Naturales, CSIC Madrid, 27, 55-177, 186-205, 224-236.
Álvarez F., Emig C.C. & Tréguier J. (2016). Brachiopodes actuels : historique et révision de la collection D.-P. Œhlert (Laval) ; brachiopodes des côtes françaises métropolitaines. Bulletin de la Société des Sciences naturelles de l'Ouest de la France, hors-série 1, 386 p. - & - & Sciences etc, Annales des collections de Sciences et techniques du Musée des Sciences de Laval, hors-série 1, 386 p.
Álvarez F., Emig C.C. & Tréguier J. (2017). Brachiopodes actuels : historique et révision de la collection D.-P. Œhlert (Laval) ; brachiopodes des côtes françaises métropolitaines. Carnets de Géologie, CG2017_B02, 386 p.
Anastasios A. (ed.) (2013). Methods for the Study of Marine Benthos. 4e édition, Wiley-Blackwell, Chichester, 496 p.
Aradas A. (1847). Descrizione delle conchiglie fossili di Gravitelli presso Messina. Atti dell’Accademia Gioenia di Scienze naturali di Catania, (serie 2), 4, 58-88 [Brachiopoda : p. 70].
Aradas A. & Benoit L. (1870). Conchigliologia vivente marina della Sicilia e delle isole che la cireondano. Atti dell’Accademia Gioenia di Scienze naturali di Catania, (serie 3), 6, 1-324, 5 pl. [Brachiopoda : p. 106-110].
Arnaud P.M. & Emig C.C. (1987). La population, unité fonctionnelle de la biocoenose. Actes du Colloque national du C.N.R.S. « Biologie des populations », Lyon 1986, p. 69-72.
Atkins D. (1959). The growth stages of the lophophore of the brachiopod Platidia davidsoni (Eudes Deslongchamps) and P. anomioides (Philippi) with notes on the feeding mechanism. Journal of the marine biological Association of the United Kingdom, 38, 103-132.
Barrier P. (1984). Evolution tectono-sédimentaire pliocène et pléistocène du détroit de Messine (Italie). Thèse de Doctorat, Université d’Aix-Marseille 2, 270 p.
Baumiller T.K., Bitner M.A. & Emig C.C. (2006). High frequency of drill holes in brachiopods from the Pliocene of Algeria and its ecological implications. Lethaia, 39 (4), 313-320.
Bellan-Santini D. (1983). The Mediterranean benthos : Reflections and problems raised by a classification of the benthic assemblages. In : Mediterranean Marine Ecosystems. Morairou-Apostolopoulou M. & Kiortsis V. (eds.). NATO Conference Series, (1 Ecology), 8, 19-48.
Bellan-Santini D., Lacaze J.C. & Poizat C. (1994). Les biocénoses marines et littorales des côtes françaises de Méditerranée : synthèse, menaces et perspectives. Collection Patrimoines naturels, MNHN, Paris, vol. 19, 246 p.
Bitner M.A. (2007). Recent brachiopods from the Austral Islands, French Polynesia, South Central Pacific. Zoosystema, 29 (3), 491-502.
Bitner M.A. & Dulai A. (2004). Revision of Miocene brachiopods of the Hungarian Natural History Museum, with special regard to the Meznerics collection. Fragmenta Palaeontologica Hungarica, 22, 69-82.
Bitner M.A. & Logan A. (2016). Recent Brachiopoda from the Mozambique-Madagascar area, western Indian Ocean. Zoosystema, 38 (1), 5-41.
Bitner M.A., Lozouet P. & Cahuzac B. (2013). Upper Oligocene (Chattian) brachiopod fauna from the Aquitaine Basin, southwestern France and its paleoenvironmental implications. Geodiversitas, 35 (3), 579-606.
Blake N.J. & Doyle L.J. (1983). lnfaunal-sediment relationships at the shelf-slope break. In : The shelfbreak: critical interface on continental margins. Stanley D.J. & Moore G.T. (eds). SEPM Special Publications, 33, 381-389.
Blanc J.J. (1968). Sedimentary geology of the Mediterranean sea. Oceanography and marine Biology: an annual Review, 6, 377-454.
Blochmann F. (1906). Neue Brachiopoden der Valdivia- und Gaußexpedition. Zoologischer Anzeiger, 30 (21-22), 690-702 & 824.
Borghi E., Bajo Campos I. & Rico García A. (2005). Arbacina romana (Merian, 1858) from the lower Pleistocene of Favignana Island (Sicily). Parvia Naturalia, 7, 47-71.
Boullier A., Delance J.H., Emig C.C., d'Hondt J.L., Gaspard D. & Laurin B. (1986). Les populations de Gryphus vitreus (Brachiopoda) en Corse. Implications paléontologiques. Biostratigraphie du Paléozoïque, 4, 179-196, 1 Pl.
Brunton C.H.C. (1989). Some brachiopods from the Eastern Mediterranean Sea. Israel Journal of Zoology, 35, 151-169.
Brunton C.H.C. & Curry G.B. (1979). British brachiopods. Synopses British Fauna, Academic. Press Londres, vol. 17, 64 p.
Calcara P. (1845). Cenno sui molluschi viventi e fossili della Sicilia da servire di supplimento ed insieme di critiche osservazioni all'opera di R. A. Philippi. Reale Stamperia e Libreria, Palerme, 65 p., pl. I-IV.
Carpine C. (1970). Écologie de l’étage bathyal dans la Méditerranée occidentale. Mémoires de l’Institut océanographique de Monaco, 2, 1-146.
Carus J.V. (1893). Prodromus faunae mediterraneae, sive Descriptio animalium maris Mediterranei incolarum, quam comparata silva rerum quatenus innotuit, adiectis locis et nominibus vulgaribus eorumque auctoribus, incommodum zoologorum. Schweizerbartsche Verlag, Stuttgart, vol. 2, 854 p. [Brachiopoda : p. 54-61]
Cohen B.L., Balfe P., Cohen M. & Curry G.B. (1993). Molecular and morphometric variation in European populations of the articulate brachiopod Terebratulina retusa. Marine Biology, 115, 105-111.
Cohen B.L., Kaulfuss A. & Lüter C. (2014). Craniid brachiopods: aspects of clade structure and distribution reflect continental drift (Brachiopoda: Craniiformea). Zoological Journal of the Linnean Society, 171 (1), 133-150.
Collins M.J. (1986). Post mortality strength loss in shells of the Recent articulate brachiopod Terebratulina retusa (L.) from the west coast of Scotland. Biostratigraphie du Paléozoïque, 4, 209-218.
Cooper G.A. (1977). Brachiopods from the Caribbean sea and adjacent waters. Studies of tropical Oceanography, Miami, 14, 1-211.
Cooper G.A. (1973). Vema's Brachiopoda (Recent). Smithsonian Contributions to Paleobiology, 17, 51 p., 9 pl.
Cooper G.A. (1983). The Terebratulacea (Brachiopoda), Triassic to Recent: A study of the Brachidia (loops). Smithsonian Contributions to Paleobiology, 50, 1-445.
Cormaci M., Funari G. & Alongi G. (2014). Flora marina bentonica del Mediterraneo: Chlorophyta. Bollettino Accademia Gioenia Scienze naturale, 47 (377), 11-436.
Costello M.J. & Chaudhary C. (2017). Marine biodiversity, biogeography, deep-sea gradients, and conservation. Current Biology, 27 (11), R511-R527.
Courp T. & Monaco A. (1990). Sediment dispersal and accumulation on the continental margin of the Gulf of Lions: sedimentary budget. Continental Shelf Research, 10, 1063-1087.
Cuvier G. (1798). Tableau élémentaire de l'histoire naturelle des animaux. Baudouin, Paris, 710 p. (pl. I-XIV).
Dall W.H. (1920). Annotated list of the Recent Brachiopoda in the Collection of the United States National Museum, with descriptions of thirty-three new forms. Proceedings of the U. S. National Museum, 57 (2314), 261-377.
Darlu P. & Tassy P. (2018). La reconstruction phylogénétique. Editions Matériologiques, Paris, 2e édition, 430 p.
Davidson T. (1852). Sketch of a classification of Recent Brachiopoda based upon internal organisation. Annals and Magazine of natural History, (series 2) 9, 361-377.
Davidson T. (1864). Description of the Brachiopoda. Annals and Magazine of Natural History, (series 3), 14, 5-11.
Davidson T. (1869). Notes on some Recent Mediterranean species of Brachiopoda. Annals and Magazine of Natural History, (series 4) 3, 374-377.
Davidson T. (1870). On Italian Tertiary brachiopoda. Geological Magazine, 7, 359-370, 399-408, 460-466.
Davidson T. (1880). Report on the Brachiopoda dredged by the HMS Challenger during the years 1873-1876. Report of the scientific Results of the Voyage of H. M. S. Challenger during the years 1873-76, Zool. 1 (1), 1-67, pl. 1-4.
Davidson T. (1886-1888). A monograph of the Recent Brachiopoda (1886-1888). Transactions of the Linnean Society of London, (2) 4 (Zoology), part I : p. 1-74, pl. 1-13 (1886) ; part II : p. 75-182, pl. 14-25 (1887) ; part III : p. 183-248, pl. 26-30 (1888).
Delance J.H. & Emig C.C. (2004). Drilling predation on Gryphus vitreus (Brachiopoda) off the French Mediterranean coasts. Palaeogeography, Palaeoclimatology, Palaeoecology, 208 (1-2), 23-30.
Deshayes G.P. (1863). Catalogue des Mollusques de l'ile de la Réunion (Bourbon). In : Notes sur l'Ile de la Réunion, Maillard L. (ed.). Dentu, Paris, 144 p., 41 pl.
Di Geronimo I. (1979). Il pleiostocene in facies batiale di Valle Palione (Grammichele, Catania). Bollettino malacologico, Milano, 15 (5-6), 85-156.
Di Geronimo I. (1984). Stabilité des peuplements et stabilité des bassins sédimentaires. Geobios, Mémoire spécial, 8, 145-150.
Di Geronimo I. (1987). Bionomie des peuplements benthiques des substrats meubles et rocheux plio-quaternaires du Détroit de Messine. Documents et Travaux de l’IGAL (Institut géologique Albert-de-Lapparent), 11, 153-169.
Di Geronimo I. (1990). Biogeografia dello zoobenthos del Mediterraneo: origine e problematiche. Oebalia, supplement 16, 31-49.
Emig C.C. (1966). Anatomie et écologie de Phoronis psammophila Cori (Golfe de Marseille; Etang de Berre). Recueil des Travaux de la Station marine d’Endoume, Marseille, 40, 161-248.
Emig C. C. (1983). Appareillages et techniques utilisés en océanographie. Description et mise en oeuvre. CNRS - Formation des marins océanologues, Marseille, 2e édition, 172 p.
Emig C.C. (1985a). Distribution et synécologie des fonds à Gryphus vitreus (Brachiopoda) en Corse. Marine Biology, 90, 139-146.
Emig C.C (1985b). Phylogenetic systematics in Phoronida (Lophophorata). Zeitschrift für zoologische Systematik und Evolution Forschungen, 23 (3), 184-193.
Emig C.C. (1987). Offshore brachiopods investigated by submersible. Journal of experimental and marine Biology and Ecology, 108, 261-273.
Emig C.C. (1988). Les Brachiopodes actuels sont-ils des indicateurs (paléo)bathymétriques ? Géologie méditerranéenne, 15 (1), 65-71.
Emig C.C. (1989a). Distribution bathymétrique et spatiale des populations de Gryphus vitreus (Brachiopoda) sur la marge continentale (Nord-Ouest Méditerranée). Oceanologica Acta, 12 (2), 205-209.
Emig C.C. (1989b). Distributional patterns along the Mediterranean continental margin (Upper Bathyal) using Gryphus vitreus (Brachiopoda) densities. Palaeogeography, Palaeoclimatology, Palaeoecology, 71, 253-256.
Emig C.C. (1989c). Observations préliminaires sur l'envasement de la biocoenose à Gryphus vitreus (Brachiopoda), sur la pente continentale du Nord de la Corse (Méditerranée). Origines et conséquences. Comptes-Rendus de l’Académie des Sciences de Paris, 309 (série III), 337-342.
Emig C.C. (1990). Examples of post-mortality alteration in Recent brachiopod shells and (paleo)ecological consequences. Marine Biology, 104, 233-238.
Emig C.C. (1997a). Bathyal zones on the Mediterranean continental slope: An attempt. Publicaciones Especiales del Instituto Español de Oceanografía, 23, 23-33.
Emig C.C. (1997b). Ecology of the inarticulated brachiopods. Biogeography of the inarticulated brachiopods. In : Kaesler R.L. ed., Treatise on Invertebrate Paleontology. Part H revised Brachiopoda. Geological Society of America and University of Kansas. Boulder, Colorado, and Lawrence, Kansas, vol. 1, 473-502.
Emig C.C (2002). Death: a key information in marine palaeoecology. In : Current topics on taphonomy and fossilization. Col.lecció Encontres, Valencia, 5, 21-26.
Emig C.C. (2008). On the history of the names Lingula, anatina, and on the confusion of the forms assigned them among the Brachiopoda. Carnets de Géologie [Notebooks on Geology], Article 2008/08 (CG2008_A08), 13 p., 10 fig. , 2 tabl.
Emig C.C. (2010). Brachiopoda. Biologia Marina Mediterranea, 17 (suppl. 1), 586-588.
Emig C.C. (2012). Révision des espèces de brachiopodes décrits par A. Risso. Carnets de Géologie [Notebooks on Geology], Article CG2012_A02 (CG2012_A02), 15-30.
Emig C.C. (2013). Daniel Œhlert (1849-1920) : biographie scientifique et bibliographie. Carnets de Géologie [Notebooks on Geology], Article 2013/08 (CG2013_A08), 303-314.
Emig C.C. (2014). Novocrania turbinata synonyme de N. anomala. Carnets de Géologie [Notebooks on Geology], 14 (8), p. 159-170.
Emig C.C. (2016). Les Brachiopodes des côtes françaises métropolitaines. Bulletin de la Société des Sciences Naturelles de l'Ouest de la France, hors-série 1, 129-167 et 183-188. - & Sciences etc, Annales des collections de Sciences et techniques du Musée des Sciences de Laval, hors-série 1, 129-167 et 183-188.
Emig C.C. (2017a). Les Brachiopodes des côtes françaises métropolitaines. In : Álvarez F., Emig C.C. & Tréguier J., Brachiopodes actuels : historique et révision de la collection D.-P. Œhlert (Laval) ; brachiopodes des côtes françaises métropolitaines. Carnets de Géologie, CG2017_B02, 386 p.
Emig C.C. (2017b). Atlas of Antarctic and sub-Antarctic Brachiopoda. Carnets de Géologie, CG2017_B03, 93 p.
Emig C.C. (2018). BrachNet. Accessed at http://paleopolis.rediris.es/BrachNet/CLASS/Taxindex.htm on 30-11-2018.
Emig C.C. & Arnaud P.M. (1988). Observations en submersible sur la densité des populations de Gryphus vitreus (Brachiopodes) le long de la marge continentale de Provence (Méditerranée nord-occidentale). Comptes-Rendus de l’Académie des Sciences de Paris, 306 (série III) (16), 501-505.
Emig C.C., Bhaud M. & Liberman M. (1987). Engins mis en service sur les navires océanographiques côtiers (1re partie), 34 minutes. Réalisateur Lecomte J. ; co-production CNRS-Formation permanente & CNRS-PIROcéan ; éditeur : CNRS-Audiovisuel, Paris.
Emig C.C., Bitner M.A. & Álvarez F. (2013). Phylum Brachiopoda. Zootaxa, 3703 (1), 75-78.
Emig C.C., Bitner M.A. & Álvarez F. (2015). Scientific death-knell against databases? Errors induced by database manipulations and its consequences. Carnets de Géologie, 15 (16), 231-238.
Emig C.C., Bitner A.M. & Álvarez F. (2018). Brachiopoda Database. Accessed at http://paleopolis.es/brachiopoda_database/ on 30-11-2018.
Emig C.C. & García-Carrascosa M.A. (1991). Distribution of Gryphus vitreus (Born, 1778)(Brachiopoda) on transect P2 (Continental margin, French Mediterranean coast) investigated by submersible. Scientia marina, 55 (2), 383-388.
Emig C.C. & Geistdoerfer P. (2004). The Mediterranean deep-sea fauna: historical evolution, bathymetric variations and geographical changes. Carnets de Géologie [Notebooks on Geology], Article 2004/01 (CG2004_A01), 10 p., 4 fig., 3 tabl.
Emig C.C. & Geistdoerfer P. (2008). Les échanges de la faune profonde en Mer Méditerranée. In : "La Méditerranée autour de ses îles", sous la direction de Emig C.C., Villain-Gandossi C. & Geistdoerfer P. Actes des Congrès nationaux des Sociétés historiques et scientifiques (version électronique), p. 31-43. Editions CTHS, Paris.
Emig C.C. & Rachebœuf P.R. (1990). Systèmes biologiques et Taphonomie: un point de vue biologique. Comunicación de la Reunión de Tafonomía y Fosilización, Madrid 1990, p. 87-93.
Ercegovic A. (1957). Principes et essai d'un classement des étages benthiques. Recueil des Travaux de la Station marine d’Endoume, Marseille, 22, 17-21.
Eudes-Deslongchamps E. (1855). On a new species of Morrisia. In : Davidson T., A few remarks on the Brachiopoda. Annals and Magazine of natural History, (series 2), 16, 443-444, pl. 10.
Eyzaguirre-Philippi M.T. (2008). Homenaje : Rodulfo Amando Philippi (1808-1904) - Explorador de nuestra biodiversidad. Gayana Botnica, Concepcin, 65 (2), VII-XI.
Falconetti C. (1980). Bionomie benthique des fonds situés à la limite du plateau continental du Banc du Magaud (Iles d'Hyères) et de la région de Calvi (Corse). Thèse de Doctorat es-Sciences, Université de Nice, 287 p.
Fischer P. & Œhlert D.-P. (1891). Brachiopodes. Expeditions scientifiques du « Travailleur » et du « Talisman » pendant les années 1880, 1881, 1882, 1883, Masson, Paris, 2, 1-140.
Fleming J. (1822). The philosophy of zoology, or, A general view of the structure, functions, and classification of animals. Constable, Edimbourg, vol. 2, 618 p.
Font J. (1990). A comparison of seasonal winds with currents on the continental slope of the Catalan Sea (Northwestern Mediterranean). Journal of Geophysical Research, 95 (C2), 1537-1545.
Fredj G. & Falconetti C. (1977). Sur la présence d'algues filamenteuses perforantes dans le test des Gryphus vitreus (Born) (Brachiopodes terebratulidés) de la limite inférieure du plateau continental méditerranéen. Comptes-Rendus de l’Académie des Sciences de Paris, 284 B, 1167-1170.
Fredj-Reygrobellet D. & G. Fredj, 1982. Etat des recherches sur les populations méditerranéennes de Gryphus vitreus (Born) de la limite inférieure du plateau continental. Bulletin de la Société zoologique de France, 107 (2), 217-223.
Gaetani M. (1986) Brachiopod palaeocommunities from the Plio/Pleistocene of Calabria and Sicilia (Italy). Biostratigraphie du Paléozoïque, 4, 281-288.
Gaetani M. & D. Saccà (1983). Brachiopodi neogenici pleistocenici della Provincia di Messina e della Calabria meridionale. Geologica Romana, 22, 1-43.
Gaetani M. & Saccà D. (1984). Brachiopodi batiali nel Pliocene e Pleistocene di Sicilia e Calabria. Rivista italiana di Paleontologia e Stratigrafia, 90 (3), 407-458.
Gautier Y. & Picard J. (1957). Bionomie du banc du Magaud (Est des Iles d'Hyères). Recueil des Travaux de la Station marine d’Endoume, Marseille, 21 (12), 28-40.
Gmelin J.F. (1789). Systema Naturae, editio decima tertia aucta. Reformata I. Ps. VI, Vermes. Beer, Leipzig, p. 3021-4120.
Goujard A. & Fourt M. (2012). Atlas thématique de la campagne MEDSEACAN (têtes des canyons méditerranéens continentaux) novembre 2008 - avril 2010. Phase 3. Partenariat Agence des aires marines protégées - GIS Posidonie. GIS Posidonie, Marseille, 100 p.
Granier J. (1978). Notes sur quelques brachiopodes dragués par les chalutiers du Grau-du-Roi (Gard). Bulletin mensuel de la Société linnéenne de Lyon, 47 (2), 66-69.
Grinyó J., Gori A., Greenacre M., Requena S, Canepa A., Lo Iacono C., Ambroso S., Purroy A. & Gili J.M. (2018). Megabenthic assemblages in the continental shelf edge and upper slope of the Menorca Channel, Western Mediterranean Sea. Progress in Oceanography, 162, 40-51.
Guille A. (1970). Bionomie benthique du plateau continental de la côte catalane française. 2. Les communautés de la macrofaune. Vie et Milieu, 21 (1B), 149-280.
Helmcke J.G. (1939). Die Brachiopoden des Zoologischen Museums zu Berlin. III. Sitzungsberichte der Gesellschaft Naturforschender Freunde zu Berlin, Jahrgang 1938 (Oktober-Dezember), p. 221-268.
Helmcke J.G. (1940). Die Brachiopoden der Deutschen Tiefsee-Expedition. Wissenschaftliche Ergebnisse der Deutschen Tiefsee-Expedition auf dem Dampfer "Valdivia" 1898-1899, Fischer, Jena, 24 (3), 216-316.
Huang D. & Su J. (1991). On the stability of fronts near shelfbreak. Acta oceanologica sinica, 10, 167-181.
Huault V. (1990). Modélisation de la morphologenèse d'une térébratule actuelle : Gryphus vitreus. Ontogenèse, variation morphologique et prospective méthodologique. Mémoire de DEA, Université de Bourgogne, Dijon, 44 p.
Huthnance J.M. (1992). Extensive slope currents and ocean-shelf boundary. Progress in Oceanography, 29, 61-196.
ICZN - International Commission on Zoological Nomenclature (1999). International Code of Zoological Nomenclature / Code International de Nomenclature Zoologique. The International Trust for Zoological Nomenclature, Londres, 4e édition, 306 p.
Jeffreys J.G. (1878). On the Mollusca procured during the "Lightning" and "Porcupine" expeditions 1868-1870. Part 1. Proceedings of the zoological Society of London, 1878, 393-416.
Kornmann P. & Sahling P.H. (1980). The shell-inhabiting, marine alga Ostreobium quekettii Bornet & Flahault is a distinct species reproducing by zoospores with four flagella. Helgoländer Meeresuntersuchungen, 34, 115-122.
Lamarck J.P.B.A., Monet de (1801). Histoire naturelle des animaux sans vertèbres, ou Tableau général des classes, des ordres et des genres de ces animaux; présentant leurs caractères essentiels et leur distribution, d'après la considération de leurs rapports naturels et de leur organisation, et suivant l'arrangement étable dans les galeries du Muséum d'Hist. Naturelle parmi leurs dépouilles conservées; Précédé du discours d'ouverture du Cours de Zoologie , donné dans le Muséum National d'Histoire Naturelle l'an 8 de la République. Déterville, Paris, vol. 6 (1e partie), 432 p.
Laubier L. & Emig C.C. (1993). La faune benthique profonde de Méditerranée. In : Symposium Mediterranean Seas 2000, Della Croce F.R. (ed.), Istituto di Scienze ambientali marine, S. Margherita Ligure, p. 397-428.
Ledoyer M. (1987). Les cumacés méditerranéens profonds (Crustacea) des campagnes Biomède I et II et Balgim. Synthèse de la.distribution bathyale du groupe en Méditerranée occidentale. Mésogée, 47, 59-70.
Lee D.E. & Brunton C.H.C. (1986). Neocrania n. gen., and a revision of Cretaceous-Recent brachiopod genera in the Family Craniidae. Bulletin of the British Museum of natural History (Geology), 40 (4), 141-160.
Lee D.E. & Smirnova T.N. (2006). Terebratuloidea. In : Kaesler R.L. ed., Treatise on Invertebrate Paleontology. Part H revised Brachiopoda. Geological Society of America and University of Kansas. Boulder, Colorado, and Lawrence, Kansas, vol. 6, 2054-2081.
Linné C. (1767). Systema naturae per regna tria naturae: secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Editio duodecima reformata. Laurentii Salvii, Stockholm, p. 533-1327.
Lipparini T., Malatesta A., Nicosia M.L. & Valdinucci A. (1981). Pliocene a quaternario del capo Milazzo in Sicilia. Bollettino del Servizio geologico d'Italia, 77 (4/5), 579-604.
Logan A. (1979). The Recent Brachiopoda of the Mediterranean Sea. Bulletin de l’Institut océanographique de Monaco, 72 (1434), 1-112.
Logan A. (1998). Recent Brachiopoda from the oceanographic expedition Seamount 2 to the north-eastern Atlantic in 1993. Zoosystema, 20, 549-562.
Logan A. & Long S.L. (2001). Shell morphology and geographical distribution of Neocrania (Brachiopoda, Recent) in the eastern North Atlantic and Mediterranean Sea. Systematic Association Special Volume Series, 63, 71-79.
Lovén S. (1846). Nordens Hafs-Mollusker. Brachiopoda. Index Molluscorum litora Scandinaviae occidentalia habitantium. Öfversigt af Kungliga svenska Vetenskaps-akademiens Förhandlingar 1846, Stockholm, (3) 6 (7), 182-184.
Lüter C. & Sieben K. (2005). Types of recent Brachiopoda in the Museum für Naturkunde, Berlin - catalogue and taxonomic notes. Mitteilungen aus dem Museum für Naturkunde in Berlin, (Zoologische Reihe), 91 (2), 177-192.
Maugeri Patanè G. (1929). Brachiopodi postpliocenici delle marne a briozoi dei dintorno di Augusta (Sicilia). Palaeontographia italica, Memorie di Paleontologia, Pisa, 29-30, 89-128, pl. 27-28.
Meznerics I. (1943). Die Brachiopoden des ungarischen Tertiärs. Annales historico-naturales Musei Nationalis, Hungarici, 36, 10-60.
Michelotti G. (1847). Description des fossiles des terrains miocènes de l'Italie septentrionale. Natuurkundige Verhandelingen van de Hollandsche Maatschappij der Wetenschappen te Haarlem, 3 (2), 1-408. [Brachiopodes : p. 75-80]
Millot C. (1987). Circulation in the Western Mediterranean sea. Oceanologica Acta, 10, 143-149.
Monaco A., Biscaye P., Soyer J., Pocklington R. & Heussner S. (1990). Particle fluxes and ecosystem response on a continental margin: the 1985-1988 Mediterranean ECOMARGE experiment. Continental Shelf Research, 10, 809-839.
Monterosato T. de (1879). Note sur les espèces de Platidia. Journal de Conchyliologie, 27, 306-308, pl. 13, fig. 3.
Mougenot D., Boillot G. & Rehault J.P. (1983). Prograding shelfbreak types on passive continental margins: some European examples. In : The shelfbreak: critical interface on continental margins, Stanley D. J. & Moore G. T. (eds). SEPM Special Publications, 33, 61-77.
Nauendorf A., Wörheide G. & Lüter C. (2014). Revision of the brachiopod genus Amphithyris (Rhynchonelliformea : Platidiidae) with descriptions of two new species. Zootaxa, 3847 (2), 221-240.
Œhlert D.-P. & Deniker M. (1883). Observations sur le développement des brachiopodes par M. Kowalevski. Archives de Zoologie experimentale et générale, Paris, (2) 1, 57-76.
Orbigny A. d' (1847). Considérations zoologiques et géologiques sur les Brachiopodes. Annales des Sciences naturelles, (3e série), 8, 241-270, pl. 7.
Pergent G., Bellan-Santini D., Bellan G., Bitar G. & Harmelin J.G. (2007). Manuel d’interprétation des types d’habitats marins pour la sélection des sites à inclure dans les inventaires nationaux de sites naturels d’intérêt pour la conservation. PNUE-PAM-CAR/ASP eds. CAR/ASP publ., Tunis, 199 p.
Pérès J.M. (1982). Ocean Management. In : Marine Ecology, Kinne O. (ed.). Wiley-Interscience Publ., Chichester, vol. 5 (1), 9-642.
Pérès J.M. (1985). History of the Mediterranean biota and colonization of the depths In : Western Mediterranean. Pergamon, Oxford, p. 198-232.
Pérès J. M. & Picard J. (1964). Nouveau manuel de bionomie benthique. Recueil des Travaux de la Station marine d’Endoume, Marseille, 31 (47), 5-137.
Picard J. (1965). Recherches qualitatives sur les biocoenoses marines des substrats meubles dragables de la région marseillaise. Recueil des Travaux de la Station marine d’Endoume, Marseille, 52 (36), 1-160.
Picard J. (1971). Les peuplements de vase au large du Golfe de Fos. Téthys, 3, 569-618.
Philippi R.A. (1836). Enumeratio molluscorum Siciliae cum viventium tum in tellure tertiaria fossilium quae in itinere suo observavit. [Volumen secundum continens addenda et emendanda, nec non comparationem faunae recentis Siciliae cum faunis aliarum terrarum et com fauna periodi tertiariae]. Anton, Halis saxorum, vol. 1, 268 p., 12 pl. [Brachiopoda : p. 94-100]
Philippi R.A. (1844). Enumeratio molluscorum Siciliae cum viventium tum in tellure tertiaria fossilium quae in itinere suo observavit. [Volumen secundum continens addenda et emendanda, nec non comparationem faunae recentis Siciliae cum faunis aliarum terrarum et com fauna periodi tertiariae]. Anton, Halis saxorum, vol. 2, 303 p., 18 pl. [Brachiopoda : p. 66-70]
Poli G.S. (1795). Testacea Utriusque Siciliæ Eorumque Historia Naturalis et Anatome. Tabulis Aeneis Illustrata. Regio Typographeio, Parme, vol. 2, 356 p. & vol. 4 pl. XXX.
Poutiers J. (1987). Was there any deep water formation in the Mediterranean sea before 8000 years BP? Deep-Sea Research, 34, 309-312.
Reeve L. (1861a). A revision of the history, synonymy, and geographical distribution of the recent Terebratulæ. Annals and Magazine of natural History, 7 (3), 169-190.
Reeve L. (1861b). On the Recent Terebratulæ; in reply to some observations by Prof. E. Suess of Vienna. Annals and Magazine of natural History, 7 (3), 443-448.
Retzius A.J (1781). Crania oder Todtenkopfs-Muschel. Schriften der Berlinischen Gesellschaft Naturforschender Freunde, 2, 66-76.
Reyss D. (1970). Bionomie benthique de deux canyons sous-marins de la mer Catalane : le rech du Cap et le rech Lacaze-Duthiers. Thèse de Doctorat ès-Sciences, Université de Paris, 251 p.
Robinson J. (2014). The muscles, body wall and valve-opening mechanism of extant craniid (inarticulated) brachiopods. Journal of natural History, 48 (21-22), 1231-1252.
Robinson J.H. (2017). A review of all Recent species in the genus Novocrania (Craniata, Brachiopoda). Zootaxa, 4329 (6), 501-559.
Rojas A., Gracia A. & Patarroyo P. (2015). Brachiopods from off the San Bernardo Archipelago (Colombian Caribbean), with comments on specific synonymies in Tichosina Cooper, 1977. Zootaxa, 3914 (1), 55-63.
Ruggiero E.T. & Raia P. (2010). Bioerosion structures and their distribution on shells of the Lower Pleistocene terebratulid brachiopod Gryphus minor. Palaeogeography, Palaeoclimatology, Palaeoecology, 293 (1-2), 157-166.
Saccà D. (1985). Variabilità del brachidio di Gryphus minor (Philippi) Terebratulida, Brachiopoda. Rivista italiana di Paleontologia e Stratigrafia, 91 (3), 409-424.
Saccà D. (1986). Megerlia echinata (Terebratulida, Brachiopoda) nel Pliocene de lla Sicilia e della Calabria meridionale. Rivista italiana di Paleontologia e Stratigrafia, 92 (2), 281-292.
Saccà D. (1992). Platidia anomioides (Scacchi & Philippi) e Platidia davidsoni (Deslongchamps) (Terebratulida, Brachiopoda) nel Pleitocene della Sicilia orientale. Rivista italiana di Paleontologia e Stratigrafia, 98 (1), 101-114.
Sacco F. (1902). I brachiopodi dei terreni terziarii del Piemonte e della Liguria. Claussen, Turin, 48 p., 6 pl.
Salat J. & Font J. (1987). Water mass structure near and offshore the Catalan coast during the winters of 1982 and 1983. Annales Geophysicae, 5B, 49-54.
Salen-Picard C. (1982). Contribution à l'étude dynamique de peuplements marins de substrats meubles : les peuplements macrobenthiques circalittoraux soumis à l'envasement dans la région provençale. Thèse de Doctorat es-Sciences, Université d'Aix-Marseille, 268 p.
Savoye B. & Piper D.J.W. (1993). Quaternary sea-level change and sedimentation on the continental shelf and slope of Antibes, French Riviera. Geo-Marine Letters 13, 2-8.
Seguenza G. (1862a). Sulla formazione Miocenica di Sicilia: ricerche e considerazioni. In : Politica e Commercio, Messina, 15 p.
Seguenza G. (1862b). Notizie succinte intorno alla costituzione geologica dei terreni terziarii del distretto di Messina. Dissertazione pel concorso alla cattedra di storia naturale nell'Università di Messina. Capra, Messina, 84 p., 2 pl.
Seguenza G. (1865a). Breve cenno di ricerche geognostiche ed organogra fiche intorno ai Brachiopodi terziarii delle roce messinesi. Annali dell’Accademia degli Aspiranti naturalisti di Napoli, serie 3, 5, 1-24.
Seguenza G. (1865b). Paleontologia malacologia delle rocce terziarie del distretto di Messina: Classe Brachiopodi. Memorie della Società italiana di Scienze naturali, Milano, 1, 5-88.
Seguenza G. (1870). Dei brachiopodii viventi e terziarii, publicati dal Prof. O. G. Costa, esame di G. Seguenza. Bullettino della Società malacologico italiano, Pisa, 3 (1), 145-160.
Seguenza G. (1871). Studii paleontologici sui brachiopodi terziarii dell'Italia meridionale. Bullettino malacologico italiano, 4 (1), 9-16 ; 4 (2), 33-72, pl. 1 ; 4 (4), 124-153, pl. 2.
Stanley D.J, Addyand S.K. & Behrens E.W. (1983). The mud-line: variability of its position relative to shelf-break. In : The shelfbreak: critical interface on continental margins, Stanley D.J. & Moore G.T. (eds.). SEPM Special Publications. 33, 279-298.
Suess E. (1859). Über die Wohnsitze der Brachiopoden. Sitzungsberichte der Heidelberger Akademie der Wissenschaften. Mathematisch-Naturwissenschaftliche Klasse, 37, 185-248. & 39, 151-206.
Suess E. (1861). On the Recent Terebratulae. Annals and Magazine of natural History, 7 (3), 382-386.
Taddei Ruggiero E. (1988). Analisi paleoecologica di un affioramiento di Calcareniti di Gravina. Atti del 4° Simposio di Ecologia e Palaeoecologia delle Comunità bentoniche, Sorrento 1988, p. 443-454.
Taddei Ruggiero E. (1994). Brachiopods from bio- and thanatocoenoses of the Isca submarine cave (Sorrento Peninsula). Bollettino della Società paleontologica italiana, Special Volume 2, 313-323.
Taddei Ruggiero E. & Bitner M.A. (2008). Bioerosion on brachiopod shells - a Cenozoic perspective. Earth and Environmental Science Transactions of the Royal Society of Edinburgh, 98, 369-378.
Taddei Ruggiero E. & Taddei R. (2006). I brachiopodi delle calcareniti di Castro Marina (Lecce). Thalassia Salentina, 29, suppl., 301-310.
Taviani M. (2002). The Mediterranean benthos from late Miocene up to present: ten million years of dramatic climatic and geologic vicissitudes. Biologia marina Mediterranea, 9 (1), 445-463.
Taviani M., Angeletti L., Canese S., Cannas R., Cardone F., Cau A., Cau A.B., Follesa M.C., Marchese F., Montagna P. & Tessarolo C. (2017). The “Sardinian cold-water coral province” in the context of the Mediterranean coral ecosystems. Deep-Sea Research, Part II, 145, 61-78.
Tett P. (1990). The photic zone. In : Light and life in the sea. Cambridge University Press, Cambridge, p. 59-87.
Thomson J.A. (1927). Brachiopod morphology and genera (Recent and Tertiary). Manual, New Zealand Board of Science and Art, 7, 1-338, 2 pl.
Tselepides A. & Eleftheriou A. (1992). South Aegean (Eastern Mediterranean) continental slope benthos: macroinfaunal-environment relationships. In : Deep-sea food chains and the global carbon cycle, Rowe G.T. & Pariente V. (eds.). Kluwer Academic Publishers, Dordrecht, p. 139-156.
Vanney J.-R. & Gennesseaux M. (1988). Versants escarpés dans une mer jeune : Reconnaissance en submersible en mer Tyrrhénienne. Acta Geographica, 71, 1-12
Vanney J.-R. & Stanley D.J. (1983). Shelfbreak physiography: an overview. In : The shelfbreak: critical interface on continental margins. Stanley D.J. & Moore G.T. (eds). SEPM Special Publications, 33, 1-24.
Wang D.P., Vieira J., Salat J., Tintore P. & La Violette P.E. (1988). A shelf/slope frontal filament off the northeast Spanish coast. Journal of marine Research, 46, 321-332.
Williams A. & Carlson S. (2007). Affinities of brachiopods and trends in their evolution. In : Selden P.A. (ed.), Treatise on Invertebrate Paleontology. Part H revised Brachiopoda. Geological Society of America and University of Kansas. Boulder, Colorado, and Lawrence, Kansas, vol. 6, 2822-2877.
Wood W. (1828). Supplement to the Index testaceologicus, or, A catalogue of shells, British and foreign. Wood, Londres, 59 p., 8 pl.
Zaharias P. & Sanders M.T. (eds) (2018). Introduction aux méthodes comparatives phylogénétiques. Biosystema, vol. 31, 98 p.
Appendice A.
Pour un renouvellement de la taxinomie des brachiopodes actuels.
Parmi les grands groupes zoologiques, les brachiopodes ont une spécificité liée à leur ancienneté dans les registres fossiles (parmi les plus anciens fossiles connus) et par leur relativement petit nombre d’espèces actuelles : ce sont, à de rares exceptions près, que des paléontologues qui les étudient, jusqu’à en devenir une « chasse-gardée » par et pour ces derniers (Emig, 2008). En conséquence, la taxinomie des espèces a été faite selon une systématique à tendance paléontologique [14], voire stratigraphique et même géographique, c’est-à-dire basée sur les seuls caractères (certains sans valeur taxinomique) des restes fossiles que sont la coquille et ses structures internes, parfois modifiées par la taphonomie (Emig & Rachebœuf, 1990 ; Emig, 2002). Utilisée pour définir certains étages stratigraphiques, la même espèce fossile de brachiopode peut parfois changer de nom en changeant d’étage !
Le nombre de taxons fossiles décrits est de l’ordre de 30 000 espèces qui s’avèrent aujourd’hui très largement sur-estimées (tout comme pour les genres) - peut-être à réduire de moitié ? - tandis qu’il est probable que 5-10% des espèces actuelles dites valides soient en fait des synonymes d’espèces déjà décrites (Emig, 2017b). Une conséquence de l’absence de diagnoses [10] complètes à tous les niveaux hiérarchiques, ce qui, alors que le nombre de caractères disponibles est faible, a conduit à utiliser des variations d’un caractère comme critère pour décrire de nouvelles espèces ou genres, même parfois à partir de quelques fragments de coquille. Ces tendances héritées du XIXe siècle sont restées vivaces pour certains paléontologues jusqu’à nos jours. Les six espèces de brachiopodes, récoltées dans le Bathyal méditerranéen, attestent, à elles seules, de toutes les ambiguïtés de la systématique utilisée actuellement. Une rapide évolution vers les nouvelles méthodes comparatives phylogénétiques, dont la cladistique, est nécessaire, car ces dernières ont connues un développement rapide au cours des vingt-cinq dernières années (Darlu & Tassy, 2018).
Le grand nombre de variétés et de synonymes (actuelles ou fossiles) de ces six espèces, souvent sans critères clairs pour les différencier, traduit le problème que pose l’absence de diagnose et d’études des variations des caractères au sein et entre les différentes populations constituant l’espèce. Dans le cas présent, il s’agit surtout de descriptions par des auteurs italiens et anglophones. Et il n’est pas sûr qu’il soit possible de faire une liste exhaustive de ces variétés et synonymes en les rapportant avec certitude à l’une ou l’autre des espèces valides, tant les descriptions sont vagues. Cette tendance se poursuit dans des travaux récents sur les formes fossiles, elle concerne parfois des individus de petite taille (millimétrique) ce qui devrait interroger les auteurs quant au développement en cours de vie de certains caractères. En effet, bien des formes juvéniles peuvent ne pas posséder tous les caractères pour déterminer avec certitude l'appartenance à une espèce
A partir de ce constat, dont le but ici n’est pas de stigmatiser auteurs et discipline, et encore moins de polémiquer, il faut se poser la question « cette systématique reste-t-elle transposable aux espèces actuelles ? » et la réponse est sans conteste NON. Car les caractères taxinomiques et phylogénétiques dépassent les seuls restes fossiles utilisés jusqu’à présent, c’est-à-dire la coquille. Il est vrai que les paléontologues ne sont ni enseignés, ni équipés pour étudier la morphologie et l’anatomie du corps (aussi nommé les parties molles) des brachiopodes, ni les moyens écologiques et océanographiques pour établir les caractéristiques du biotope et des biocœnoses. Or, c’est bien là que se trouvent des caractères pour définir les espèces actuelles et leurs populations. Combien de descriptions renseignent sur les muscles, le lophophore, les gonades, la larve et son ontogenèse, les spicules, etc. ? Cependant, depuis quelques années, on assiste à un accroissement des publications sur la biologie, l’anatomie et l’écologie des espèces actuelles de brachiopodes ; mais ce n’est pas pour autant que les systématiciens des brachiopodes les aient intégrées dans leurs travaux.
Un point souvent évoqué dans des publication est la baisse constante du nombre de taxons de brachiopodes depuis le Mésozoïque ; or, le nombre d’espèces actuelles, environ 400 (Emig et al., 2018), couvre une période d’au moins un million d’années, et, dans le passé géologique, il n’existe aucune donnée sur le nombre réel d’espèces valides pour une période similaire. Reste l’habitude de véhiculer des concepts qui mériteraient d’être revus et affinés (Emig, 2002, 2017b, Emig et al., 2015).
La systématique des espèces actuelles de brachiopodes nécessite donc une profonde révision dans ses concepts et méthodes, comme cela se fait dans les autres groupes zoologiques (Zaharias & Sanders, 2018), hors du seul contexte paléontologique. L’application de la cladistique prévue dans le projet pour la révision de la part H (Brachiopoda) du Treatise on Invertebrate Paleontology, n’a jamais atteint le niveau genre et espèce (Williams & Carlson, 2007). S’y est ajoutée la tendance génétique qui reste incapable d’identifier les espèces qui sont déterminées selon la systématique classique. Dans les bases de données génétiques, les espèces valides voisinent avec des synonymes mentionnés comme valides ou traités comme tels.
La systématique dans les sciences de vie n’est qu’un outil, certes indispensable, mais pas une fin en soi, comme cela est souvent le cas en paléontologie. Identifier à partir d’une diagnose fiable est la base pour tout travail ultérieur, comme ici sur la distribution des espèces dans le Bathyal : la présence des espèces dans une ou plusieurs biocœnoses est une donnée à intégrer dans la description des espèces, voire comme caractère taxinomique dans leur systématique.
Une espèce doit avoir une diagnose explicite, comme le genre auquel elle appartient doit avoir l a sienne distincte de celle des espèces qu’il regroupe. Dans ce dernier cas, la diagnose ne comporte que les seuls caractères taxinomiques, mais tous, permettant d’identifier le genre selon la définition donnée dans le code [10] (ICZN, 1999). Ces caractères dans les formes actuelles ne peuvent se résumer à ceux de la seule coquille. Les parties anatomiques, comme les muscles, les néphridies, le lophophore et la disposition des tentacules, la reproduction (des gonades à la métamorphose de la larve), sont autant de données pouvant contenir des critères d’identification, même s’ils ne sont disponibles durant toute la vie d’un individu. Ceci rend d’autant plus primordial d’en connaître toutes les variations au cours du cycle de vie.
En outre, parmi les spécialistes des brachiopodes, il a trop souvent confusion entre diagnose et description qui sont deux termes à signification bien différente et qui ne peuvent se substituer l’une à l’autre. La description concerne l’ensemble des observations sur les exemplaires récoltés au-delà de la diagnose, en complétant les connaissances sur le mode de vie, de reproduction, le lieu de vie et la faune environnante, les conditions écologiques, etc. De même, il y a souvent confusion entre la diagnose du genre et celle de l’espèce : c’est une ineptie d’écrire pour un genre monospécifique : « même diagnose que pour l’espèce » ou « as for species ». Ne désirant pas me fâcher avec mes collègues et sans vouloir blâmer des disparus, je laisse à chacun le soin de trouver ces manquements dans les travaux récents au cours du dernier siècle ou plus.
Le temps est venu d’une nouvelle approche dans un contexte phylogénétique pour les espèces actuelles de brachiopodes.
[14] En France, la paléontologie est considérée comme appartenant aux Sciences de la Vie comme aux Sciences de la Terre (plus dans un sens environnemental).
Appendice B.
Historique de la systématique de Terebratula minor Philippi, 1836
Philippi (1836) créa une variété fossile nommé minor de l’espèce Terebratula vitrea, dont elle se distingue seulement par la petite taille de la coquille (Fig. B-1): il indique une taille maximale de 7,5 ’’’ (ou lignes - soit 17 mm, sachant qu’une ligne correspond à 2,256 mm en unité française). Les exemplaires provenaient de Calabre (Italie du Sud) notamment d’Ibiso, Arcile et Moline di Scordia (Philippi, 1836, 1844).

Figure B-1 : Fac-similé de la description de Philippi (1836 et 1844) sur la variété minor. Ligne (ou ’’’) = 2,256 mm en unité française. Terebratula vitrea est Gryphus vitreus (Born, 1778).
Suess (1859) a distingué Terebratula minor de T. vitrea parce que « kleinere Art mit stumpfen Bändern und stärkerer Schal » et a nommé ses spécimens vivants T. vitrea minor ou T. minor provenant des environs de l'île de Lipari (au Nord-Est de la Sicile, Italie), aujourd'hui Gryphus vitreus. Reeve (1861a) place T. minor en synonymie avec T. vitrea, ce qui entraina la réponse suivante de Suess (1861) : « Nor do I approve the altered generic position of several species, or the uniting of T. minor with T. vitrea. » Dans sa réplique, Reeve (1861b) ne répondra pas sur ce point.
Seguenza (1865b, 1870) a souligné que Terebratula minor n'est pas distincte de T. vitrea (Tableau 11) ; sa comparaison reste ambiguë : « Dalle esposte osservazioni conchiudiamo, che le T. minor può ritenersi como specie differente dall T. vitrea, ma essa non no è ben distinta. » Dans son tableau I, cet auteur montre les similitudes entre les trois espèces qui en fait sont des variations menant toutes à Gryphus vitreus, donc à comparer avec Boullier et al. (1986), Huault (1990) (Fig. 5-5). D'autres formes, comme T. leylliana (Tableau 11 ; voir Davidson, 1870), ont peu de différences avec la coquille de T. minor et que Seguenza (1871) a qualifié de T. minor. Davidson (1880) reconnaît que : « T. vitrea varies much, and several of its varieties or modifications in shape have been described as distinct species. » Néanmoins quelques lignes après il maintient Terebratula vitrea, var. minor tout en soulignant : « it is often difficult distinguishable from the young shell of T. vitrea. » Les localités se situent dans l’océan Atlantique (depuis l’Arctique au cap de Bonne-Espérance), en mer Méditerranée, et des fossiles dans le Sud de l’Italie. Et il ajoute : « The question may, indeed, be further mooted, whether Philippi was not correct in considering Ter. minor or affinis as merely a small variety of Ter. vitrea. Professor Suess, however, believes the former shell to be specifically distinct from Ter.vitrea. Dr Gwyn Jeffreys and my self were also at one time disposed to consider the Ter. davidsoni, A. Adams (Annals and Mag. Nat. Hist., 3d ser., vol. v. p. 12, 1860, dredged at Satanomoski, Japan), as identical with Ter. vitrea or affinis. This view is not, however, shared by our distinguished contemporary, Mr Dall. » Néanmoins, en 1886, Davidson écrit : « I have compared species of the fossil shell with species dredged alive by Prof. Seguenza in the bay of Messina, and found them to be identical I cannot, however, get rid of the idea that Liothyris minor is more than a small race or variety of Liothyris vitrea; it occurs, associated with the last-named shell, in the same beds and localities in Calabria and in Sicily. Kowalevski (in Œhlert & Deniker, 1883) fait quelques observations sur l'embryologie de Terebratula minor. Carus (1893) cite de nombreuses localités de la forme vivante de Terebratula affinis (= minor) (Tableau 11) en mer Méditerranée (Adriatique, mer Égée, Sicile, Corse, Alger, Tunis, Marseille…) qui sont à attribuer à Gryphus vitreus.
Maugeri Patanè (1929) considère Terebratula (Liothyrina ) minor comme distincte de Gryphus vitreus : « ha una linea di commessura fortemete accentuata (quasi aussente nella vitrea ), nonchè apparicchio brachiale puitosto parallelo, che nella vitrea è quasi triangolare com'ebbero un osservare Aradas e Benoit (1870) » ; et il décrit trois variétés, nommées depressa, globosa et rotundata , fondées principalement sur la forme de la coquille, en précisant que T. minor est présente dans le bassin méditerranéen occidental. Ses figures 1 à 3, pl. 28, confirment la similitude avec G. vitreus (à comparer avec la Fig. 5-5). Lipparini et al. (1981) ont signalé Terebratula (Liothyrina) sphenoidea et T. (Liothyrina) vitrea var. minor dans le Pliocène au Cap Milazzo (Sicile).
Créant le nouveau genre Eurysina basé sur la diagnose suivante : « Tichosina avec un angle de boucle supérieur à 25° », Cooper (1983) y a transféré Terebratula minor Philippi. Mais, cette position n’a jamais été acceptée par les auteurs récents. Enfin, Eurysina a été mis en synonymie avec Tichosina par Lee & Smirnova (2006) : les diagnoses publiées par ces deux derniers auteurs des genres Tichosina et Stenosarina apparaissent fort similaires, pouvant conduire à une synonymie.
Gaetani (1986), Gaetani & Saccà (1983, 1984), Saccà (1985) ont décrit Gryphus minor au Miocène Supérieur et au Pléistocène en Sicile et en Calabre, en considérant l'espèce comme distincte par les caractéristiques externes de sa coquille. Des valves éparses de G. minor et de Terebratula scillae Seguenza, 1871 sont rapportées dans des gisements pléistocènes en Sicile par Borghi et al. (2005).
Selon Taddei Ruggiero (1994), Gryphus minor a été connu depuis le Miocène et au moins jusqu’au Pléistocène supérieur ; mais elle remarque qu'aujourd'hui une forme semblable à G. minor est toujours associée à G. vitreus. Dans le registre fossile, G. minor vivait sur des fonds vaso-détritiques rapportés au Circalittoral (vers 70 à 120 m de profondeur). D'après Taddei-Ruggiero & Bitner (2008), les brachiopodes du Pléistocène inférieur en Calabre sont représentés par sept espèces, dont les plus communes sont Terebratula scillae, Gryphus vitreus et G. minor, avec d'autres espèces comme Terebratulina retusa, Megerlia truncata, Dallina septigera et Macandrevia cranium.
Ruggiero & Raia (2010) ont décrit G. minor en grande abondance dans un sable siliciclastique-carbonate d’environ 1 m d’épaisseur : la fraction vaseux augmente dans le haut de la couche et pourrait être responsable de la fossilisation. Ils considèrent cette espèce comme une espèce méditerranéenne éteinte valide, ayant été attribuée de diverses manières à des espèces ou sous-espèces distinctes, dont dilatatus (Jeffreys), elongatus(Jeffreys) selon que les coquilles soient plus larges, plus étroites ou plus allongées. D’autres auteurs, dont Logan (1979), Boullier et al. (1986) et Huault (1990) ont montré, voire démontré, que la variabilité des formes est une caractéristique de Gryphus vitreus qu’il faut nécessairement prendre en compte, tout comme la distribution géographique et biocœnotique des populations.
Au cours des nombreuses expéditions récentes en Méditerranée, Gryphus minor n'a jamais été formellement identifiée, ni considérée comme une forme juvénile de G. vitreus, à cause des grandes variations des caractères de cette dernière espèce (Boullier et al., 1986 ; Huault, 1990).
Tableau 11 : Liste des espèces ou variétés (depuis le Miocène) se rapportant à Terebratula minor, considérée aujourd’hui comme synonyme de Gryphus vitreus. Cette liste n’est pas exhaustive, mais traduit bien la complexité et l’ambigüité par absence de vrais caractères taxinomiques pour rapporter avec certitude des individus à une espèce identifiable.
| Terebratula vitrea var. minor, Philippi, 1836 | Philippi (1836) | |
| Terebratula affinis Calcara, 1845 | Calcara (1845) | |
| Terebratula miocenica Michelotti, 1847 | a | Michelotti (1847) |
| Terebratula vitrea (Anomia) | Aradas (1847), Reeve (1861a), Seguenza (1870) | |
| Terebratula minor | Suess (1859, 1861) | |
| Terebratula affinis | Seguenza (1862a, 1862b) | |
| Terebratula miocenica | a | Seguenza (1862b) |
| Terebratula minor | * | Seguenza (1863, 1865a, 1865b, 1871) |
| Terebratula minor | Davidson (1864, 1880) | |
| Terebratula minor | Davidson (1864) | |
| Terebratula lyelliala Seguenza, 1865 | Seguenza, 1865a) | |
| Terebratula rovasendianus Seguenza, 1866 | Seguenza, (1866) | |
| Terebratula minor = T. affinis | Aradas & Benoit (1870) | |
| Terebratula lyelliala | Davidson (1870) | |
| Terebratula minor | Seguenza (1871-1874) | |
| Terebratula vitrea var. minor | Davidson (1886) | |
| Terebratula vitrea var. minor = T. affinis | * | Davidson (1880) |
| Terebratula vitrea var. minor = T. affinis | * | Jeffreys (1878) |
| Terebratula affinis | * | Carus (1893) |
| Terebratula minor | Sacco (1902) | |
| Terebratula (Liothyrina) minor | Maugeri Patanè (1929) | |
| Terebratula (Liothyrina) minor var. depressa | Maugeri Patanè (1929) | |
| Terebratula (Liothyrina) minor var. globosa | Maugeri Patanè (1929) | |
| Terebratula (Liothyrina) minor var. rotundata | Maugeri Patanè (1929) | |
| Terebratula vitrea var. minor | * | Granier (1978) |
| Gryphus miocaenicus | a | Meznerics (1943) |
| Terebratula (Liothyrina) vitrea var. minor | Lipparini et al . (1981) | |
| Eurysina minor | * | Cooper (1983) |
| Gryphus minor | Gaetani (1986), Gaetani & Saccà (1983, 1984), Saccà (1985) | |
| Liothyrina agulhasensis Helmcke, 1939 | b * | Helmcke (1939, 1940) |
| Gryphus minor | Taddei Ruggiero (1988), Taddei Ruggiero (1994), | |
| Gryphus minor | Borghi et al. (2005) | |
| Gryphus minor | Taddei-Ruggiero & Bitner (2008), Ruggiero & Raia (2010) | |
| Gryphus miocaenicus | a | Bitner & Dulai (2004) |
* Des exemplaires actuels ont été signalés sous ce nom d'espèce par l'auteur.
a. Terebratula miocenica a été décrite par Michelotti (1847, p. 76) de Serravalle Scrivia, situé à environ 50 km au nord de Gênes (Italie), en soulignant que: « le front enfin, qui dans l'espèce de l'auteur Anglais est coupé en ligne droite, est arrondi dans notre espèce. Ce dernier caractère suffit à lui-seul pour la distinguer également de la Terebratula vitrea de Lamarck. » Il faut souligner que le nom correct de l'espèce est miocenica ou miocenicus. Meznerics (1943) décrit cette espèce sous Gryphus, mais n’évoque pas T. minor au sein de sa longue liste de Terebratula dans des gisements tertiaires de Hongrie. Récemment, Bitner & Dulai (2004) confirment que cette espèce, petite en taille, appartient bien au genre Gryphus avec une commissure antérieure rectimarginate comme chez Gryphus vitreus : elle est connue depuis l’Éocène jusqu’à nos jours. En l’absence de description des structures internes de la coquille, il est impossible d’identifier des exemplaires pouvant se référer à G. miocenicus.
b. Des exemplaires de cette espèce, nommée Liothyrina agulhasensis par Helmcke en 1939, avaient été mentionnés et figurés par Blochmann (1906) sous « Liothyrina n. sp. von Agulhasbank ». Helmcke (1940) les met comme synonyme à cette nouvelle espèce Terebratula vitrea var. minor Philippi décrite et figurée par Davidson (1880) et récoltée au Cap de Bonne-Espérance (Afrique du Sud) ; il fait aussi une comparaison avec Liothyrella affinis (Calcara). Liothyrina agulhasensis a été classée sous Xenobrochus agulhasensis (Helmcke, 1939). A noter que la date de parution du travail d’Helmcke est bien 1939, et non comme parfois indiquée par erreur 1938.
Pour clore, cet exposé, il est intéressant de reproduire la planche 1 de Seguenza (1871) avec les caractéristiques des coquilles de Terebratella minor Philippi et de T. sphenoidea Philippi ; ces espèces considérées ici comme synonymes respectivement de Gryphus vitreus (Born, 1778) et de Stenosarina sphenoidea (Philippi, 1844) que Logan (1998) avait renommée sous S. davidsoni Logan, 1998.
A consulter les descriptions des nombreuses espèces de brachiopodes fossiles par les auteurs cités dans le Tableau 11, il faut élargir la question de la validité de toutes ces espèces de brachiopodes décrites depuis l'Éocène dans le domaine méditerranéen : combien sont réellement identifiables en reéxaminant tous les caractères taxinomiques et leurs variations. En même temps, il faut vérifier en se basant sur leurs variations que les caractères disponibles sur les formes fossiles sont suffisants pour discriminer des individus jusqu’à l’espèce, surtout quand ces formes sont toujours vivantes dans le milieu marin (voir Appendice A). La révision de la taxinomie des brachiopodes n'est pas une litote, mais une nécessité, notamment pour pouvoir appéhender la biodiversité vraie et son évolution à travers les temps géologiques jusqu'à nos jours.
Figure B-2 : Extrait en fac-similé de la planche I (espèce fossili) de Seguenza (1871).
12. Esemplare del pliocene superiore di Catanzaro.
13. (ingrandita). Un individuo del pliocene superiore di Gravitelli presso Messina.
14. Esemplare del pliocene di Gravitelli della var. Lyelliana (ingrandito).
15. Un individuo dello Zancleano sup. di cui sono più appa riscenti le pieghe della contrada Pietrazza presso Messina (ingrandito).
16. Apparecchio apofisario ingrandito del pliocene superiore di S. Filippo presso Messina.
16 bis. Varietà troncata ed elargato alla fronte, pliocene superiore di S. Filippo.
17. Apparecchio apofisario ingrandito della T. Lyelliana di Gravitelli.
Terebratula sphenoidea, Philippi.
18. Un esemplare ristretto alla fronte dello Zancleano superiore della contrada Pietrazza: presso Mess.
19. Un esemplare di forma tipica, contrada Pietrazza.
20. Forma allungata dello stesso luogo e terreno.
21. Un giovane dello miocène medio di Scirpi presso Mess.
22. Una forma breve e larga di Scirpi nello Zancleano medio.
23. Un esemplare colla troncatura frontale meno distinta, SCIRPI.
24. Un altro assai breve colla maggior larghezza verso la metà del medesimo luogo e terreno.
25. Un grande esemplare e largo, dello Zancleano superiore di Trapani presso Messina.
26. Apparecchio apofisario de un esemplare della Contrada Pietrazza.
Appendice C.
Historique de la systématique de Terebratula seminulum Philippi, 1836
Terebratula seminulum a été récoltée en mer profonde au large de Drépane aujourd'hui Trapani (Tràpani en siciclien, Drépanon en grec ancien ou Drepanum en latin), un port situé à l’extrémité occidentale de la Sicile (Italie). Elle a été décrite par Philippi en 1836 et représentée sur sa pl. VI, fig. 15 (Fig. C-1).

Figure C-1 : Fac-similé de la description originale de Terebratula seminulum et de la fig. 15 pl. VI par Philippi (1836), représentant Terebratula seminulum, avec l’extrait de la légende correspondant à la fig. 15 (voir texte ci-dessous). La longueur de la coquille est d’environ une ligne (ou ’’’), soit environ 2,3 mm.
Philippi (1844) considére T. seminulum comme synonyme d’Orthis neapolitana Scacchi, aujourd’hui Joania cordata (Risso, 1826) (Fig. C-2). En effet, en observant la Fig. C-1, on ne peut que conclure que ce sont deux espèces distinctes qui sont représentées : a-d - pouvant bien correspondre à Platidia (ou Amphithyris ?) et e-f - à Joania (?) (Fig. C-2). ) : cette ambigüité se retrouve ensuite dans le débat sur l’identité des exemplaires représentés en les référant tous à la même espèce, ce qui est probablement erroné.

Figure C-2 : Fac-similé de l’extrait de Philippi (1844) classant T. seminulum avec Orthis neapolitana, décrite par Scacchi en 1833 - aujourd'hui Joania cordata.
Davidson (1852, 1887) considère Terebratula seminulum comme appartenant au genre Platidia, en indiquant que T. appressa Forbes, 1844, récoltée en mer Egée était synonyme. Pourtant, en 1852 (p. 371), Davidson observe que : « Philippi’s species has been mistaken by Sowerby, who gave the name seminulm to another form which we have called Argiope Forbesii. » A. forbesii Davidson, 1852 est synonyme de Joania cordata. Dans aucun de ses deux travaux, il ne fait référence au changement fait par Philippi (1844).
Fischer & Œhlert (1891) estime que la forme du lophophore n’est pas celui des Platidia, mais peut-être celui des Cistella (genre qui correspond actuellement à Argyrotheca Dall, 1900 et à Joania Álvarez, Brunton et Long, 2008). Ils font aussi référence à une figure de Monterosato (1879) (Fig. C-4) ; or ce dernier auteur considère que seminulum est une Platidia et il écrit que Philippi (1844) « la rapporte, par inadvertance, au T. Neapolitana, Scacchi. » Thomson (1927) place T. seminulum dans le genre Amphythyris Thomson, 1918 en considérant que dans Davidson (1887, pl. 20, fig. 20-22) : « Philippi’s figures reproduced by Davidson leaves no doubt as to distinct characters of the lophophore. » (Fig. C-3) et donc que Davidson (1887), puis Dall (1920) ont assigné par erreur cette espèce à Platidia. Atkins (1959, fig. 23, p. 126) compare les figures de Philippi (1836) avec un individu de Platidia anomioides de même taille, soit environ 2 mm. Elle en conclut que T. seminulum est une forme juvénile de P. anomioides, comme l’a déjà mentionné Jeffreys (1878). À noter que la forme du lophophore n'est définitive que chez un adulte mature, puisqu'au cours du développement d’un individu, cette forme évolue, comme le fait aussi remarquer Atkins (1959). Ainsi, elle ne peut être considérée comme un caractère taxinomique, mais seulement comme un caractère additionnel (dans sa forme adulte), comme cela a été démontré dans le groupe voisin des Phoronida par Emig (1985b).
|
Figure C-3 : Fac-similé des figures 20-22 de la pl. 21 de Davidson (1887, d’après Philippi, 1836) représentant Terebratula seminulum. Elles correspondent respectivement aux figures 15 d, e, b de Philippi (1836) (Fig. C-1). |
Figure C-4 : Fac-similé de la figure 3, pl. 13 de Monterosato (1879). |
Dans la collection du Museum für Naturkunde (Berlin, Allemagne), Lüter & Sieben (2005) ont découvert une petite boîte avec plusieurs exemplaires étiquetés : « Terebratula seminulum Ph., Sicilia, Dr. Ph. » En les examinant, ils ont trouvé que ces exemplaires correspondaient à deux espèces différentes et de conclure que, sur la figure originale de Philippi (1836), les coquilles a-d correspondaient à Platidia anomioides et celles e-g à Joania cordata (Fig. C-1). On peut se poser demander si cette boîte n'a pas été oubliée par Rudolph Amandus Philippi (1808-1904) quand il a émigré au Chili en 1854 ; en effet, selon une descendante Eyzaguirre-Philippi (2008 ; et communication personnelle), il avait emporté sa bibliothèque personnelle et ses collections à Santiago du Chili.
C’est dans la collection de Davidson au British Museum de Londres que MacKinnon et al. (2008) ont découvert cinq exemplaires étiquetés « Platidia seminulum : specimens described and given to me by Marquis of Monterosato as belonging to Philippi’s species, Journ. de Conchyliologie » provenant de Méditerranée, ainsi que qu’un autre individu marqué « P. anomioides, Canon Norman Collection, Naples » : leur examen a conduit ces auteurs à les identifier comme Amphithyris seminula (Philippi, 1836), confirmant cette espèce dans ce genre par Thomson (1927). Mais, ils ne citent pas la publication de Lüter & Sieben (2005). En outre, il est quand même curieux que Davidson n’ait jamais évoqué la possession de ces spécimens dans sa collection, d’autant qu’il décède en 1885 avant même la parution de sa monographie 1886-1888, dans laquelle il reproduit les trois figures de Philippi (1836) (Fig. C-2, C-3) sans mentionner les exemplaires donnés par de Monterosato. Par ailleurs, lors de son voyage à Nice (avec des contacts avec des collègues italiens) à la demande de J.G. Jeffreys, Davidson (1869) n’évoque aucune relation avec de Monterosato. Ce voyage fut initié afin de vérifier avec minutie la validité des espèces de brachiopodes décrites par Antonio Risso (1777-1845), un pharmacien naturaliste italien (Emig, 2012). Ses travaux n’avaient guère satisfait ces auteurs anglais comme l’écrit Davidson (1869) : « consequently we must not be surprised to find so large an amount of error in the work above specified. » Il n’est pas sûr que la communauté scientifique italienne ait apprécié !
Nauendorf et al. (2014) décrivent Terebratula seminulum sous Amphithyris seminula (Philippi, 1836) en considérant que toutes les références à un autre genre faites par les divers auteurs sont érronées et que leurs specimens sont à mettre sous le nom de genre Amphithyris. Le type de cette espèce a été choisi parmi les exemplaires de Philippi, cités sous Platidia anomioides par Lüter & Sieben (2005). Cependant, ces exemplaires, au moins certains, auraient été inclus dans la collection de Helmcke (1940) ; or, cet auteur n’a pas fait de travaux sur les brachiopodes méditerranéens mais au contraire antarctiques. Dans l’inventaire du Zoologischen Museum zu Berlin, dressé par Helmcke en 1939, on trouve Argyrotheca cistellula sous la mention « Trapani (Philippi) » et « Palermo (Monterosato) », des Joania cordata sous « Trapani (Monterosato) », des Megathiris detruncata sous « Trapani (Philippi) », des Platidia anomioides sous « Palermo (Monterosato) ».
Récemment, Tréguier et Álvarez (in Álvarez et al., 2016, 2017) ont étudié la collection du marquis de Monterosato (1841-1927), appartenant au Musée des Sciences de Laval (France). Cette collection de coquilles vivantes de mer Méditerranée, déterminée par de Monterosato, avait été achetée en 1893 par Daniel Œhlert, paléontologue et spécialiste de brachiopodes (Emig, 2013). Les brachiopodes proviennent tous de la mer Méditerranée, près de la côte Ouest de l’Italie et aux alentours des îles de la Corse, de la Sardaigne et de la Sicile. Parmi ceux-là des exemplaires d’Argyrotheca cuneata, Joania cordata et Megerlia truncata récoltés à Trapani, mais pas de Platidia.
Difficile de conclure avec certitude, car les contradictions subsistent et apparaissent à travers cet historique, auxquelles il faut ajouter le fait qu’aucune signalisation du genre Amphithyris n’a jamais été faite en mer Méditerranée au cours de siècles de récolte, notamment pour les individus référables à Platidia (Fig. 5-8), que le genre Amphithyris est restreint au Sud Pacifique, à l’Afrique du Sud et à l’Antarctique. Il ne s’agit pas de mettre en doute l’identification des exemplaires, mais de s’interroger sur leur origine. La solution se trouve probablement au large des côtes siciliennes, et plus largement méditerranéennes. En attendant, la présence d’Amphithyris en mer Méditerranée apparaît comme fort peu probable.
Brachiopodes récoltés lors de campagnes (1976-2014) dans l’étage Bathyal des côtes françaises méditerranéennes.
Redéfinition des limites du système phytal dans le domaine marin benthique.
 |
ISBN13 :978-2-916733-16-6 "Dépôt légal à parution" Manuscript online on December 10, 2018 |
 |
Copyright  |
||