◄ Carnets Geol. 16 (18) ►
Sommaire
[Introduction]
[Contexte stratigraphique]
[Matériels et méthodes]
[Résultats]
[Discussion et conclusion]
[Références bibliographiques] et ...
[Planche]
Office National des Mines, 24, rue de l'énergie, 2035 La Charguia,
Tunis (Tunisie)
UFR Sciences de la Mer,
Faculté des Sciences, Université Abdelmalek-Essaadi, BP 2121, Mhanech, Tétouan
(Maroc)
Dipartimento di Scienze Biologiche, Geologiche ed Ambientali, Università di
Catania, Corso Italia 55, 95129 Catania (Italie)
Faculté des Sciences de
Tunis, Département de géologie, Université de Tunis El Manar, 2092 El Manar
(Tunisie)
UFR Sciences de la Mer,
Faculté des Sciences, Université Abdelmalek-Essaadi, BP 2121, Mhanech, Tétouan
(Maroc)
Office National des Mines, 24, rue de l'énergie, 2035 La Charguia, Tunis (Tunisie)
Faculté des Sciences de Tunis, Département de géologie, Université de Tunis El Manar, 2092 El Manar (Tunisie)
Manuscrit en ligne depuis le 12 septembre 2016
[Éditeur : Bruno ; éditeur
linguistique : Bruno ]
Cet article présente, pour la première fois, une étude détaillée des ostracodes des dépôts sédimentaires du Pliocène supérieur-Pléistocène inférieur affleurant au niveau de l'Oued Lebna (bordure orientale du Cap Bon, Tunisie nord orientale). Les analyses qualitative et quantitative ont permis de retracer l'évolution paléo-environnementale de cette région depuis un milieu marin relativement profond ou circalittoral à la base de la série passant progressivement à un environnement moins profond, jusqu'à un milieu infralittoral interne à côtier au sommet de la coupe. Il est particulièrement important du point de vue paléoécologique de signaler la présence de Bythocythere turgida qui ne vit plus en Méditerranée et qui est rapportée aux phases froides du Pléistocène.
• Tunisie orientale ;
• Pliocène
supérieur-Pléistocène inférieur ;
• Ostracodes ;
• Foraminifères ;
• Évolution paléoenvironnementale.
Temani R., Nachite D., Sciuto F., Razgallah S., Bekkali R., Hayet K. & Gaaloul N. (2016).- Les Ostracodes plio-pléistocènes des séries sédimentaires de la bordure orientale du Cap Bon (coupe de l'Oued Lebna, Tunisie orientale).- Carnets Geol., Madrid, vol. 16, no. 18, p. 431-447.
Plio-Pleistocene Ostracods from sedimentary sections along the eastern edge of Cape Bon (Wadi Lebna section, Eastern Tunisia).- This paper presents for the first time a detailed study of ostracods in the Upper Pliocene-Lower Pleistocene deposits of Wadi Lebna (Cape Bon eastern edge, northeastern Tunisia). The quantitative and qualitative analyses document the evolution of this area from a marine environment dominated by relatively deep or circalittoral species at the base of the succession, passing progressively up into shallower environments, and at the top infralittoral coastal environments. Particularly important from the ecological point of view is the presence in some samples of Bythocythere turgida. This species indicates deposition of these sediments during the cold phases of the Early Pleistocene.
• Eastern Tunisia;
• Late Pliocene -
Early Pleistocene;
• Ostracodes;
• Foraminifers;
• Environmental evolution.
Parmi les organismes benthiques utilisés pour définir les conditions environnementales et paléoenvironnementales, les ostracodes sont utilisés avec succès depuis de nombreuses années dans diverses recherches géologiques, écologiques et océanographiques. Ces organismes se sont révélés être particulièrement importants à ces fins dans des environnements profonds marins (Ayress et al., 1997 ; Majoran & Dingle, 2001, entre autres), ainsi que dans les milieux marins de la plateforme continentale.
En effet, comme peu d'autres groupes taxonomiques, les ostracodes montrent une large gamme d'adaptations écologiques et comprennent des espèces typiquement marines, saumâtres et d'eau douce ; leur étude permet de définir l'évolution des environnements depuis les milieux marins jusqu'à des environnements de transition et continentaux (Frenzel & Boomer, 2005 ; Gliozzi & Grossi, 2008 ; Mischke & Holmes, 2008 ; Zaibi et al., 2011 ; Rodriguez-Lazaro & Ruiz-Muñoz, 2012, entre autres).
Vu l'importance écologique et
paléoécologique de ce groupe de micro-crustacés, nous avons pour la première
fois effectué l'étude détaillée de la séquence sédimentaire affleurant
à l'Oued Lebna, à la bordure orientale du Cap Bon (Tunisie orientale : Fig. 1 ![]() ), séquence qui s'est avérée très riche en ostracodes. Le but de notre
travail est de suivre l'évolution de ces microorganismes le long de la coupe
ainsi que l'évolution du bassin sédimentaire au cours de la transition Pliocène
- Pléistocène.
), séquence qui s'est avérée très riche en ostracodes. Le but de notre
travail est de suivre l'évolution de ces microorganismes le long de la coupe
ainsi que l'évolution du bassin sédimentaire au cours de la transition Pliocène
- Pléistocène.
Figure 1 :
Localisation de la Coupe du Barrage de l'Oued
Lebna dans la région de Cap Bon. |
Les dépôts sédimentaires affleurant dans la région du Cap Bon (Tunisie nord-orientale), attribués au Pliocène, ont fait l'objet de plusieurs études sédimentologiques (Feki, 1970 ; Colleuil, 1976 ; Ben Salem, 1992 ; Dammak, 1992), biostratigraphiques (Fournié, 1978 ; Dammak, 1992 ; Hooybergs, 1995) et tectoniques (Ben Salem, 1992).
Ces dépôts, essentiellement marneux et silico-clastiques, sont représentés en Tunisie orientale par quatre formations, de la base au sommet : les Argiles des Potiers (Colleuil, 1976), les Sables jaunes de Nabeul (Colleuil, 1976), les Argiles de Sidi Barka (Colleuil, 1976) correspondant au Zancléen (Colleuil, 1976 ; Dammak, 1992 ; Hooybergs, 1977, 1995) et les Sables et Grés de Hammamet (Colleuil, 1976) d'âge Plaisancien (Colleuil, 1976 ; Dammak, 1992).
En Tunisie septentrionale, les dépôts du "Pliocène" sont représentés par la Formation Raf Raf du "Pliocène inférieur" définie par Burollet (1951), équivalente aux formations d'âge Zancléen définies au Cap Bon, et la Formation Porto Farina du Pliocène supérieur (Plaisancien) équivalent latéral de la Formation "Sables et Grès de Hammamet" du Cap Bon.
Les études biostratigraphiques des dépôts du Pliocène nous ont permis de mettre en correspondance formations lithostratigraphiques et biozones (Tableau 1). En se référant au schéma stratigraphique proposé par Iaccarino & Premoli Silva (2007), nous arrivons à la conclusion que la Formation "Sables et Grès de Hammamet" correspond aux Biozones MPl5 et MPl6.
Tableau 1 :
Correspondance entre la lithostratigraphie et les biozones.
Table 1: Lithostratigraphy and biozone correlation.
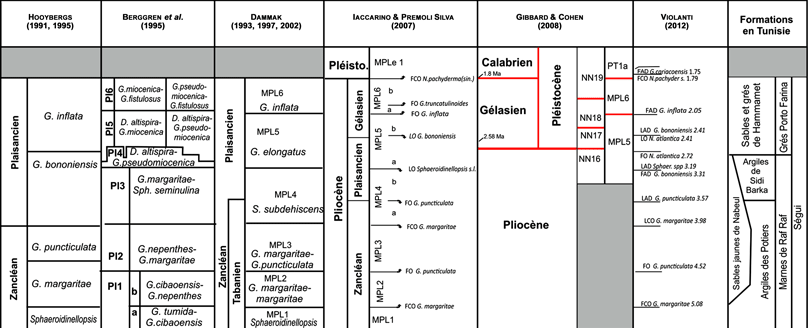
Cliquer sur la vignette pour agrandir l'image.
D'après la synthèse établie par Violanti (2012), la limite supérieure du Gélasien a été initialement décrite comme la base du Pléistocène ou "Calabrien" daté à 1,806 Ma (Lourens et al., 2004) définie en Calabre (coupe de la Vrica, sud de l'Italie), où la limite GSSP Pliocène/Pléistocène fut proposée par Aguirre et Pasini (1985) et formellement acceptée par l' IUGS en 1984 (Bassett, 1985 ; Cita, 2008).
En 2009, l'IUGS a officiellement ratifié la proposition visant à abaisser la base du Quaternaire et du Pléistocène au GSSP de l'étage Gélasien (Gibbard & Cohen, 2008 ; Gibbard & Head, 2010). En conséquence, le Gélasien représente désormais le premier étage du Pléistocène (révisé) tandis que le Calabrien représente le deuxième étage. Sur la base de cette nouvelle subdivision stratigraphique du Cénozoïque proposée par Gibbard & Cohen (2008), la partie supérieure de la subzone MPl5a, toute la subzone MPl5b et toute la biozone MPl6 sont désormais d'âge Pléistocène inférieur ou "Gélasien".
Dans la suite de notre étude, nous nous réfèrerons à cette nouvelle subdivision stratigraphique.
De ce fait, sur la base des travaux de Temani (2007), les dépôts de la coupe de l'Oued Lebna correspondent à la Formation "Sables et Grès de Hammamet".
La coupe analysée est située dans le village de
Lebna à 12 km au Nord de la ville de Korba et à 4 km au Sud de la ville de
Menzel Temime (Fig. 1 ![]() ), le long de la bordure nord-orientale de la Tunisie
(couramment appelée péninsule du Cap Bon).
), le long de la bordure nord-orientale de la Tunisie
(couramment appelée péninsule du Cap Bon).
Le secteur correspond au flanc SE de l'anticlinal du Djebel Abderrahmane. Il est affecté par une série de failles de directions variables (N50, 70, 90, 160 et 130°E) et est limité vers sa terminaison péri-anticlinale par une grande flexure ou faille normale (Ben Salem, 1992). Il s'agit d'une structure anticlinale dissymétrique s'étendant sur 25 km de longueur et 10 km de largeur de direction NE-SO qui occupe le centre du Cap Bon. Les dépôts les plus anciens datent de l'Éocène moyen. Sa mise en place est à rattacher à la phase alpine du Tortonien.
La série étudiée
(Fig. 2 ![]() ) débute par un niveau
de 3,5 m d'épaisseur d'argiles vertes à noires riches en Scaphopodes,
Lamellibranches, Gastéropodes
et Bryozoaires. Dans ces argiles sont présents deux niveaux d'épaisseur
centimétrique qui montrent une concentration élevée en macrofaune, surtout
formée d'Ostréidés et de Pectinidés. Ce niveau est connu dans la littérature
comme la Formation de Sidi Barka du Pliocène supérieur (MPl4).
) débute par un niveau
de 3,5 m d'épaisseur d'argiles vertes à noires riches en Scaphopodes,
Lamellibranches, Gastéropodes
et Bryozoaires. Dans ces argiles sont présents deux niveaux d'épaisseur
centimétrique qui montrent une concentration élevée en macrofaune, surtout
formée d'Ostréidés et de Pectinidés. Ce niveau est connu dans la littérature
comme la Formation de Sidi Barka du Pliocène supérieur (MPl4).
Figure 2 : Log stratigraphique de la succession sédimentaire
de l'Oued Lebna. |
Sur ces argiles repose, par l'intermédiaire d'une limite irrégulière, une unité sédimentaire de 5 m d'épaisseur totale, composée de niveaux sableux bioclastiques alternant avec des niveaux gréseux lumachelliques, et organisée en plusieurs rythmes. Chaque rythme montre à sa base des sables bioclastiques à granulométrie fine et homogène, de couleur jaune-ocre, qui peuvent contenir des lentilles sablonneuses. La macrofaune y est disparate, réduite à des fragments de valves de lamellibranches, des scaphopodes et des balanes. Cette unité sédimentaire se termine avec un terme gréseux très fossilifère à Pectinidés et Ostréidés de grande taille. Cette unité stratigraphique est connue dans la littérature comme la Formation des Sables et Grès de Hammamet (Office national des Mines, 2006).
Au-dessus, la coupe se termine par des conglomérats remaniant des grains de quartz, des coquilles de lamellibranches et des concrétions carbonatées surmontés par des sablons rouges et des croûtes calcaires ; dans la littérature, ceux-ci correspondent probablement au Villafranchien continental.
Pour cette étude, en se basant sur un échantillonnage
serré (Tableau 2 ; Fig. 2 ![]() ), nous avons prélevé 60 échantillons dont 15 étaient
azoïques. Chaque échantillon a été collecté et traité selon les règles (Sciuto,
2003, 2005). L'analyse de la microfaune a été effectuée sur 50 g de résidu
de lavage. Tous les spécimens d'ostracodes et des foraminifères ont été
triés à partir de la fraction supérieure à 63 µm.
), nous avons prélevé 60 échantillons dont 15 étaient
azoïques. Chaque échantillon a été collecté et traité selon les règles (Sciuto,
2003, 2005). L'analyse de la microfaune a été effectuée sur 50 g de résidu
de lavage. Tous les spécimens d'ostracodes et des foraminifères ont été
triés à partir de la fraction supérieure à 63 µm.
Tableau
2 :
Liste des ostracodes de l'Oued Lebna.
Table
2: List of the
ostracodes in the Wadi Lebna section.
| Argiles vertes à noires (Formation de Sidi Barka) | ||||||||||||||||||||||||||||
|
espèces échantillon |
Le a | Le b | Le c | Le d | Le e | Le 1a | Le 1b | Le 1c | Le 1d | Le 1e | Le-1 | Le 0 | Le 1 | Le 2 | ||||||||||||||
| Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | |
| Acanthocythereis ascoli (Puri, 1963) | 2 | 1,3 | 1 | 0,7 | 1 | 1,3 | 2 | 3,2 | 3 | 1,8 | 6 | 2,7 | 3 | 1,6 | 6 | 3,2 | 20 | 7,6 | 12 | 6,7 | 2 | 1,3 | ||||||
| Acanthocythereis hystrix (Reuss, 1850) | 8 | 3,4 | 3 | 2,1 | 3 | 3,8 | 2 | 3,2 | 3 | 2,1 | 3 | 2,2 | 5 | 3,0 | 3 | 1,4 | 6 | 3,2 | 9 | 4,9 | 16 | 6,1 | 9 | 5,0 | ||||
| Argilloecia robusta Bonaduce et al., 1975 | 1 | 0,7 | 1 | 0,7 | 1 | 1,3 | 4 | 6,5 | 6 | 3,6 | 14 | 6,3 | 4 | 2,1 | 8 | 4,3 | 10 | 3,8 | 7 | 3,9 | 11 | 7,2 | ||||||
| Argilloecia sp. A | 1 | 0,7 | 0,0 | 4 | 6,5 | 3 | 2,1 | 3 | 2,2 | 3 | 1,8 | 12 | 5,4 | 11 | 5,9 | 14 | 7,6 | 19 | 7,2 | 16 | 8,9 | 19 | 12,5 | |||||
|
Aurila cicatricosa (Reuss, 1850) |
1 | 0,7 | 2 | 1,1 | ||||||||||||||||||||||||
| Aurila cimbaeformis (Seguenza, 1883) | 2 | 1,3 | 1 | 1,0 | 5 | 3,6 | 1 | 1,3 | 6 | 9,7 | 2 | 1,4 | 2 | 1,5 | 6 | 3,6 | 4 | 1,8 | 3 | 1,6 | 3 | 1,6 | 1 | 0,4 | 2 | 1,1 | 7 | 4,6 |
|
Aurila convexa (Baird, 1850) |
50 | 33,3 | 56 | 23,6 | 34 | 24,3 | 10 | 12,8 | 9 | 14,5 | 36 | 25,4 | 36 | 26,3 | 26 | 15,5 | 16 | 7,2 | 14 | 7,4 | 15 | 8,1 | 12 | 4,6 | 12 | 6,7 | 10 | 6,6 |
| Bairdia sp. A | ||||||||||||||||||||||||||||
| Bairdia mediterranea Mueller, 1894 | ||||||||||||||||||||||||||||
| Bosquetina carinella (Reuss, 1850) | 1 | 1,0 | 3 | 2,1 | 1 | 0,7 | 2 | 1,1 | 3 | 1,6 | 6 | 2,3 | 3 | 1,7 | 2 | 1,3 | ||||||||||||
| Bosquetina dentata (Mueller, 1894) | 1 | 0,7 | 1 | 0,7 | 1 | 1,3 | 2 | 3,2 | 1 | 0,7 | 1 | 0,7 | 1 | 0,7 | ||||||||||||||
| Buntonia sublatissima (Neviani, 1906) | 2 | 1,3 | 14 | 5,9 | 2 | 1,4 | 3 | 3,8 | ||||||||||||||||||||
| Bythocythere turgida Sars, 1866 | ||||||||||||||||||||||||||||
|
Callistocythere cf. C. pallida (Mueller, 1894) |
2 | 1,3 | 3 | 1,3 | 1 | 1,3 | 1 | 0,5 | 4 | 2,2 | 6 | 2,3 | ||||||||||||||||
| Carinocythereis carinata (Roemer, 1838) | 5 | 2,7 | 6 | 3,2 | 8 | 3,0 | 11 | 6,1 | 1 | 0,7 | ||||||||||||||||||
| Cistacythereis caelatura Uliczni, 1969 | 1 | 0,7 | 1 | 0,5 | 1 | 0,7 | 1 | 1,3 | 2 | 3,2 | 2 | 1,4 | 1 | 0,7 | 4 | 2,4 | 9 | 4,1 | 8 | 4,3 | 10 | 5,4 | 7 | 2,7 | 9 | 5,0 | 6 | 3,9 |
| Costa edwardsii (Roemer, 1838) | 13 | 5,5 | 12 | 8,6 | 6 | 7,7 | 6 | 9,7 | 16 | 11,3 | 16 | 11,7 | 28 | 16,7 | 40 | 18,0 | 43 | 22,9 | 18 | 9,7 | 23 | 8,7 | 14 | 7,8 | 16 | 10,5 | ||
|
Costa nudicosta Yassini, 1980 |
||||||||||||||||||||||||||||
| Cyprideis ex groupe pannonica (Méhes, 1908) | ||||||||||||||||||||||||||||
|
Cytherella cf. C. alvearium Bonaduce et al., 1975 |
2 | 1,3 | 1 | 1,0 | 1 | 0,7 | 2 | 1,2 | 7 | 3,2 | ||||||||||||||||||
|
Cytherella cf.
C. circumpunctata Ciampo, 1976 |
3 | 2,0 | 7 | 3,0 | 1 | 0,7 | 1 | 1,3 | 2 | 3,2 | 2 | 1,4 | 2 | 1,5 | 8 | 4,8 | 14 | 6,3 | 8 | 4,3 | 10 | 5,4 | 14 | 5,3 | 10 | 5,6 | 11 | 7,2 |
| Cytherella sp. | 1 | 0,7 | ||||||||||||||||||||||||||
| Cytherella vulgatella Aiello et al., 1996 | 1 | 0,7 | 5 | 2,1 | 1 | 0,7 | 1 | 1,6 | 5 | 3,5 | 5 | 3,6 | 7 | 4,2 | 6 | 3,2 | 3 | 1,6 | 6 | 2,3 | 4 | 2,2 | 5 | 3,3 | ||||
| Cytherelloidea beckmanni Barbeito-Gonzalez, 1971 | ||||||||||||||||||||||||||||
|
Cytherelloidea cf. C. beckmanni Barbeito-Gonzalez, 1971 |
||||||||||||||||||||||||||||
| Cytheretta subradiosa (Roemer, 1838) | 1 | 0,5 | 4 | 1,5 | ||||||||||||||||||||||||
| Cytheridea neapolitana Kolman, 1960 | 47 | 31,3 | 45 | 19,0 | 53 | 37,9 | 31 | 39,7 | 10 | 16,1 | 20 | 14,1 | 20 | 14,6 | 14 | 8,3 | 12 | 5,4 | 15 | 8,0 | 10 | 5,4 | 1 | 0,4 | 11 | 6,1 | 3 | 2,0 |
| Echinocythereis scabra (Muenster, 1830) | ||||||||||||||||||||||||||||
|
Celtia emaciata (Brady, 1867) |
||||||||||||||||||||||||||||
|
Flexus triebeli (Ruggieri, 1962) |
3 | 1,4 | 5 | 2,7 | 7 | 2,7 | ||||||||||||||||||||||
| Celtia quadridentata (Baird, 1850) | ||||||||||||||||||||||||||||
|
Celtia emaciata (Brady, 1867) |
3 | 1,3 | 6 | 4,3 | ||||||||||||||||||||||||
| Leptocythere ramosa (Rome, 1942) | 16 | 6,8 | 1 | 1,3 | 1 | 0,5 | 5 | 1,9 | ||||||||||||||||||||
|
Lixouria aquila Ruggeri, 1972 |
1 | 0,7 | 1 | 1,0 | 1 | 0,7 | ||||||||||||||||||||||
| Loxoconcha sp. 1 | 1 | 0,7 | 0,0 | 14 | 5,3 | 6 | 3,3 | 13 | 8,6 | |||||||||||||||||||
| Loxoconcha sp. 2 | 1 | 0,7 | 1 | 1,0 | 1 | 0,7 | 1 | 1,3 | 2 | 3,2 | 12 | 7,1 | 4 | 1,8 | 11 | 5,9 | 10 | 5,4 | 5 | 1,9 | 2 | 1,1 | 7 | 4,6 | ||||
| Loxoconcha bairdi Mueller, 1912 | ||||||||||||||||||||||||||||
| Microcytherura sp. | 1 | 1,0 | 1 | 1,3 | 1 | 0,7 | 1 | 0,6 | 3 | 1,6 | 4 | 2,2 | 9 | 3,4 | 7 | 3,9 | 5 | 3,3 | ||||||||||
| Miocyprideis italiana Moos, 1962 | 3 | 2,0 | 1 | 0,7 | 1 | 1,3 | 7 | 5,1 | 1 | 0,6 | 2 | 0,9 | 0,0 | 6 | 2,3 | 2 | 1,1 | 1 | 0,7 | |||||||||
|
Monoceratina mediterranea Sissingh, 1972 |
||||||||||||||||||||||||||||
| Neocytherideis cylindrica (Brady, 1868) | ||||||||||||||||||||||||||||
| Palmoconcha agilis (Ruggieri, 1967) | 3 | 2,0 | 5 | 2,1 | 1 | 0,7 | 6 | 4,2 | 6 | 4,4 | 9 | 5,4 | 24 | 10,8 | 6 | 3,2 | ||||||||||||
|
Palmoconcha dertobrevis (Ruggieri, 1967) |
||||||||||||||||||||||||||||
|
Paracypris polita Sars, 1866 |
1 | 1,0 | 6 | 4,2 | 6 | 4,4 | ||||||||||||||||||||||
| Paracytheridea depressa Mueller, 1894 | ||||||||||||||||||||||||||||
|
Parakrithe robusta Bold, 1966 |
1 | 0,7 | 1 | 1,3 | 4 | 2,8 | 4 | 2,9 | 6 | 3,6 | 8 | 3,6 | 3 | 1,6 | 2 | 1,1 | 6 | 2,3 | ||||||||||
| Parakrithe sp. A | 1 | 0,7 | 1 | 0,7 | 2 | 2,6 | 2 | 3,2 | 3 | 1,8 | 5 | 2,3 | 1 | 0,5 | 2 | 0,8 | ||||||||||||
| Pterygocythereis jonesii (Baird, 1850) | 1 | 1,0 | 1 | 1,3 | 2 | 1,4 | 2 | 1,5 | 1 | 0,5 | ||||||||||||||||||
| Pterygocythereis sp. 1 | 1 | 0,7 | 4 | 1,7 | 1 | 1,3 | 2 | 3,2 | 2 | 1,4 | 2 | 1,5 | 1 | 0,6 | 1 | 0,5 | 1 | 0,5 | 1 | 0,4 | ||||||||
|
Quadracythere salebrosa (Uliczny, 1969) |
1 | 0,7 | ||||||||||||||||||||||||||
| Carinovalva carinata (Moyes, 1965) | 1 | 1,0 | 2 | 3,2 | 2 | 1,4 | 2 | 1,5 | 5 | 2,7 | 7 | 3,9 | 1 | 0,7 | ||||||||||||||
| Ruggieria tetraptera (Seguenza, 1880) | 1 | 0,7 | 2 | 0,8 | 1 | 0,7 | 2 | 2,6 | 2 | 3,2 | 4 | 2,8 | 4 | 2,9 | 6 | 3,6 | 6 | 2,7 | 5 | 2,7 | 10 | 5,4 | 11 | 4,2 | 8 | 4,4 | 10 | 6,6 |
| Urocythereis emanuelae Sciuto, 2014 | ||||||||||||||||||||||||||||
| Xestoleberis communis Mueller, 1894 | 12 | 8,0 | 7 | 3,0 | 1 | 0,7 | 1 | 1,3 | 2 | 3,2 | 1 | 0,7 | 4 | 2,4 | 9 | 4,1 | 8 | 4,3 | 6 | 3,2 | 10 | 3,8 | 8 | 4,4 | 7 | 4,6 | ||
| Xestoleberis margaritea (Brady, 1866) | 1 | 0,7 | 19 | 8,0 | 4 | 2,9 | 2 | 2,6 | 15 | 10,6 | 8 | 4,8 | 18 | 8,1 | 19 | 10,1 | 12 | 6,5 | 20 | 7,6 | 13 | 7,2 | 12 | 7,9 | ||||
| Xestoleberis sp. A | 7 | 4,7 | 20 | 8,4 | 5 | 3,6 | 4 | 5,1 | 7 | 4,9 | 15 | 10,9 | 5 | 3,0 | 4 | 1,8 | 4 | 2,1 | 8 | 4,3 | 14 | 5,3 | 5 | 2,8 | 1 | 0,7 | ||
| nombre de spécimens par échantillon | 150 | 100 | 237 | 100 | 140 | 100 | 78 | 100 | 62 | 100 | 142 | 100 | 137 | 100 | 168 | 100 | 222 | 100 | 188 | 100 | 185 | 100 | 263 | 100 | 180 | 100 | 152 | 100 |
| nombre d'espèces par échantillon | 27 | 26 | 23 | 24 | 18 | 23 | 19 | 23 | 23 | 23 | 25 | 28 | 23 | 23 | ||||||||||||||
| Sables et grès de Hammamet | ||||||||||||||||||||||||||
|
espèces échantillon |
Le 3 | Le 5 | Le 6 | Le 7 | Le 8 | Le 9 | Le 10 | Le 11 | Le 12 | Le 13 | Le 14 | Le 15 | Le 16 | |||||||||||||
| Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | |
| Acanthocythereis ascoli (Puri, 1963) | 2 | 1,0 | 3 | 2,0 | 9 | 4,4 | 0,0 | 9 | 4,6 | 1 | 0,6 | 11 | 5,7 | 1 | 4,3 | 14 | 8,3 | 22 | 6,6 | 1 | 2,0 | |||||
| Acanthocythereis hystrix (Reuss, 1850) | 4 | 1,9 | 6 | 4,1 | 9 | 4,4 | 1 | 0,7 | 7 | 3,6 | 3 | 1,5 | 4 | 2,4 | 10 | 3,8 | 20 | 6,0 | 9 | 5,1 | 1 | 2,0 | ||||
| Argilloecia robusta Bonaduce et al., 1975 | 8 | 3,8 | 6 | 4,1 | 10 | 4,9 | 7 | 5,2 | 11 | 5,7 | 6 | 3,6 | 5 | 2,6 | 2 | 8,7 | 15 | 8,9 | 14 | 5,3 | 26 | 7,8 | 8 | 4,5 | 4 | 8,2 |
| Argilloecia sp. A | 9 | 4,3 | 5 | 3,4 | 18 | 8,8 | 6 | 4,4 | 16 | 8,2 | 17 | 10,2 | 14 | 7,2 | 1 | 4,3 | 6 | 3,6 | 25 | 9,5 | 32 | 9,6 | 16 | 9,0 | 6 | 12,2 |
|
Aurila cicatricosa (Reuss, 1850) |
0,0 | 1 | 0,7 | 3 | 1,5 | 2 | 8,7 | 3 | 1,1 | 5 | 1,5 | |||||||||||||||
| Aurila cimbaeformis (Seguenza, 1883) | 4 | 1,9 | 3 | 2,0 | 8 | 3,9 | 5 | 3,7 | 3 | 1,5 | 6 | 3,6 | 7 | 3,6 | 1 | 4,3 | 6 | 2,3 | 9 | 2,7 | 4 | 2,3 | 1 | 2,0 | ||
|
Aurila convexa (Baird, 1850) |
24 | 11,5 | 20 | 13,5 | 22 | 10,8 | 12 | 8,9 | 16 | 8,2 | 12 | 7,2 | 12 | 6,2 | 5 | 21,7 | 16 | 9,5 | 25 | 9,5 | 31 | 9,3 | 17 | 9,6 | 2 | 4,1 |
| Bairdia sp. A | ||||||||||||||||||||||||||
| Bairdia mediterranea Mueller, 1894 | 0,0 | 1 | 0,5 | 3 | 1,8 | 9 | 3,4 | 6 | 1,8 | 5 | 2,8 | |||||||||||||||
| Bosquetina carinella (Reuss, 1850) | 1 | 0,5 | 1 | 0,7 | 6 | 2,9 | 3 | 2,2 | 5 | 2,6 | 2 | 1,2 | 2 | 1,0 | 8 | 4,7 | 7 | 2,7 | 11 | 3,3 | 8 | 4,5 | 2 | 4,1 | ||
| Bosquetina dentata (Mueller, 1894) | 2 | 1,4 | 6 | 2,9 | 1 | 0,7 | 4 | 2,1 | 2 | 1,2 | 2 | 1,0 | ||||||||||||||
| Buntonia sublatissima (Neviani, 1906) | ||||||||||||||||||||||||||
| Bythocythere turgida Sars, 1866 | 2 | 1,0 | 1 | 0,6 | 4 | 1,5 | 9 | 2,7 | ||||||||||||||||||
|
Callistocythere cf. C. pallida (Mueller, 1894) |
3 | 1,4 | 4 | 2,7 | 0,0 | 4 | 3,0 | 10 | 5,2 | 6 | 2,3 | 3 | 0,9 | |||||||||||||
| Carinocythereis carinata (Roemer, 1838) | 3 | 1,4 | 1 | 0,7 | 3 | 1,5 | 3 | 1,5 | 1 | 0,6 | 10 | 3,8 | 7 | 2,1 | 10 | 5,6 | ||||||||||
| Cistacythereis caelatura Uliczni, 1969 | 3 | 1,4 | 2 | 1,4 | 6 | 2,9 | 4 | 3,0 | 7 | 4,2 | 10 | 5,2 | 2 | 8,7 | 3 | 1,8 | 10 | 5,6 | 4 | 8,2 | ||||||
| Costa edwardsii (Roemer, 1838) | 12 | 5,7 | 1 | 0,7 | 0,0 | |||||||||||||||||||||
|
Costa nudicosta Yassini, 1980 |
1 | 0,7 | 4 | 2,4 | 8 | 4,1 | 4 | 2,4 | 11 | 4,2 | 10 | 3,0 | ||||||||||||||
| Cyprideis ex groupe pannonica (Méhes, 1908) | 9 | 4,3 | 7 | 4,7 | 2 | 1,5 | 14 | 7,2 | 15 | 9,0 | ||||||||||||||||
|
Cytherella cf. C. alvearium Bonaduce et al., 1975 |
||||||||||||||||||||||||||
|
Cytherella cf.
C. circumpunctata Ciampo, 1976 |
14 | 6,7 | 4 | 2,0 | 4 | 3,0 | 4 | 1,5 | 2 | 0,6 | 6 | 3,4 | ||||||||||||||
| Cytherella sp. | ||||||||||||||||||||||||||
| Cytherella vulgatella Aiello et al., 1996 | 1 | 0,7 | 0,0 | 8 | 5,9 | 7 | 4,2 | 12 | 6,2 | 4 | 1,5 | |||||||||||||||
| Cytherelloidea beckmanni Barbeito-Gonzalez, 1971 | 1 | 0,5 | ||||||||||||||||||||||||
|
Cytherelloidea cf. C. beckmanni Barbeito-Gonzalez, 1971 |
2 | 1,5 | 1 | 0,5 | 2 | 1,2 | 2 | 0,8 | ||||||||||||||||||
| Cytheretta subradiosa (Roemer, 1838) | 7 | 3,3 | 7 | 4,7 | 4 | 2,0 | 6 | 4,4 | 12 | 6,2 | 11 | 6,6 | 6 | 3,1 | 9 | 3,4 | 12 | 3,6 | 12 | 6,8 | ||||||
| Cytheridea neapolitana Kolman, 1960 | 7 | 3,3 | 8 | 5,4 | 0,0 | 6 | 3,1 | 4 | 2,4 | 8 | 3,1 | 3 | 0,9 | 4 | 2,3 | 7 | 14,3 | |||||||||
| Echinocythereis scabra (Muenster, 1830) | 3 | 1,8 | 3 | 0,9 | 2 | 1,1 | ||||||||||||||||||||
|
Celtia emaciata (Brady, 1867) |
2 | 0,8 | 1 | 0,3 | ||||||||||||||||||||||
|
Flexus triebeli (Ruggieri, 1962) |
2 | 1,4 | 6 | 2,9 | 3 | 1,5 | 1 | 0,6 | 3 | 1,8 | 12 | 3,6 | ||||||||||||||
| Celtia quadridentata (Baird, 1850) | 2 | 0,6 | ||||||||||||||||||||||||
|
Celtia emaciata (Brady, 1867) |
1 | 0,5 | 1 | 0,7 | 5 | 1,5 | ||||||||||||||||||||
| Leptocythere ramosa (Rome, 1942) | 6 | 3,1 | 8 | 3,1 | ||||||||||||||||||||||
|
Lixouria aquila Ruggeri, 1972 |
||||||||||||||||||||||||||
| Loxoconcha sp. 1 | 0,0 | 0,0 | 6 | 4,4 | 2 | 1,0 | 2 | 1,2 | 2 | 8,7 | 10 | 5,9 | 3 | 1,7 | ||||||||||||
| Loxoconcha sp. 2 | 15 | 7,2 | 14 | 9,5 | 3 | 1,5 | 9 | 6,7 | 1 | 0,6 | 6 | 3,1 | 1 | 0,6 | 2 | 1,1 | ||||||||||
| Loxoconcha bairdi Mueller, 1912 | 4 | 2,1 | 6 | 3,6 | 5 | 2,6 | 8 | 4,7 | 5 | 2,8 | 1 | 2,0 | ||||||||||||||
| Microcytherura sp. | 20 | 9,6 | 19 | 12,8 | 11 | 5,4 | 5 | 3,7 | 17 | 8,8 | 13 | 7,8 | 10 | 5,2 | 9 | 5,3 | 18 | 6,9 | 20 | 6,0 | 1 | 0,6 | ||||
| Miocyprideis italiana Moos, 1962 | 1 | 0,5 | 2 | 1,4 | 17 | 8,3 | 4 | 3,0 | 4 | 2,1 | 7 | 4,2 | 9 | 4,6 | 1 | 4,3 | 14 | 5,3 | 8 | 2,4 | 5 | 2,8 | 4 | 8,2 | ||
|
Monoceratina mediterranea Sissingh, 1972 |
1 | 0,7 | 1 | 0,5 | 3 | 1,8 | 1 | 0,3 | ||||||||||||||||||
| Neocytherideis cylindrica (Brady, 1868) | 2 | 0,6 | ||||||||||||||||||||||||
| Palmoconcha agilis (Ruggieri, 1967) | 5 | 2,4 | 2 | 1,4 | ||||||||||||||||||||||
|
Palmoconcha dertobrevis (Ruggieri, 1967) |
3 | 1,5 | 4 | 2,4 | 3 | 1,5 | 8 | 4,7 | 10 | 3,0 | 1 | 2,0 | ||||||||||||||
|
Paracypris polita Sars, 1866 |
||||||||||||||||||||||||||
| Paracytheridea depressa Mueller, 1894 | ||||||||||||||||||||||||||
|
Parakrithe robusta Bold, 1966 |
||||||||||||||||||||||||||
| Parakrithe sp. A | ||||||||||||||||||||||||||
| Pterygocythereis jonesii (Baird, 1850) | 1 | 0,5 | 1 | 0,5 | 4 | 1,5 | 1 | 0,6 | 1 | 2,0 | ||||||||||||||||
| Pterygocythereis sp. 1 | 2 | 1,0 | 1 | 0,7 | 1 | 0,7 | 1 | 0,4 | ||||||||||||||||||
|
Quadracythere salebrosa (Uliczny, 1969) |
1 | 0,7 | 3 | 1,5 | 11 | 6,5 | 13 | 5,0 | 1 | 0,3 | 8 | 4,5 | 3 | 6,1 | ||||||||||||
| Carinovalva carinata (Moyes, 1965) | 6 | 2,9 | 2 | 1,5 | 4 | 1,5 | 3 | 0,9 | ||||||||||||||||||
| Ruggieria tetraptera (Seguenza, 1880) | 19 | 9,1 | 12 | 8,1 | 23 | 11,3 | 8 | 5,9 | 14 | 7,2 | 12 | 7,2 | 6 | 3,1 | 1 | 4,3 | 6 | 3,6 | 12 | 4,6 | 12 | 3,6 | 8 | 4,5 | 3 | 6,1 |
| Urocythereis emanuelae Sciuto, 2014 | 1 | 0,7 | 1 | 0,5 | 5 | 3,0 | 19 | 7,3 | 2 | 0,6 | 6 | 3,4 | 2 | 4,1 | ||||||||||||
| Xestoleberis communis Mueller, 1894 | 9 | 4,3 | 2 | 1,4 | 10 | 4,9 | 2 | 1,5 | 9 | 4,6 | 7 | 4,2 | 12 | 6,2 | 3 | 13,0 | 7 | 4,1 | 10 | 3,8 | 10 | 3,0 | 6 | 3,4 | ||
| Xestoleberis margaritea (Brady, 1866) | 26 | 12,4 | 10 | 6,8 | 22 | 10,8 | 19 | 14,1 | 20 | 10,3 | 16 | 9,6 | 16 | 8,2 | 0,0 | 15 | 8,9 | 33 | 9,9 | 15 | 8,5 | 5 | 10,2 | |||
| Xestoleberis sp. A | 1 | 0,5 | 7 | 4,7 | 0,0 | 8 | 5,9 | 9 | 4,6 | 6 | 3,6 | 8 | 4,1 | 2 | 8,7 | 6 | 3,4 | 1 | 2,0 | |||||||
| nombre de spécimens par échantillon | 209 | 100 | 148 | 100 | 204 | 100 | 135 | 100 | 194 | 100 | 166 | 100 | 194 | 100 | 23 | 100 | 169 | 100 | 262 | 100 | 333 | 100 | 177 | 100 | 49 | 100 |
| nombre d'espèces par échantillon | 25 | 26 | 21 | 30 | 24 | 24 | 30 | 12 | 25 | 28 | 32 | 25 | 18 | |||||||||||||
| Sables et grès de Hammamet | ||||||||||||||||||||||||||||||
|
espèces échantillon |
Le 17 | Le 18 | Le 19 | Le 20 | Le 21 | Le 22 | Le 23 | Le 24 | Le 25 | Le 26 | Le 27 | Le 28 | Le 29 | Le 30 | Le 31 | |||||||||||||||
| Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | Ab | % | |
| Acanthocythereis ascoli (Puri, 1963) | 1 | 0,8 | 12 | 5,7 | 1 | 0,6 | 7 | 3,8 | 11 | 5,8 | 6 | 3,1 | 6 | 5,8 | 6 | 3,4 | 2 | 3,1 | 1 | 2,9 | 0,0 | 0,0 | 11 | 8,6 | ||||||
| Acanthocythereis hystrix (Reuss, 1850) | 7 | 5,5 | 16 | 7,7 | 18 | 11,5 | 12 | 6,5 | 15 | 7,9 | 10 | 5,2 | 2 | 1,9 | 14 | 7,8 | 1 | 4,3 | 3 | 4,6 | 1 | 2,9 | 1 | 1,4 | 2 | 2,3 | 2 | 1,6 | ||
| Argilloecia robusta Bonaduce et al., 1975 | 11 | 8,7 | 12 | 9,7 | 10 | 4,8 | 10 | 6,4 | 12 | 6,5 | 6 | 3,1 | 2 | 1,9 | 9 | 5,0 | 5 | 7,7 | 1 | 2,9 | 6 | 8,7 | 0,0 | 15 | 11,7 | |||||
| Argilloecia sp. A | 13 | 10,2 | 15 | 12,1 | 10 | 4,8 | 14 | 9,0 | 15 | 8,2 | 11 | 5,7 | 3 | 2,9 | 8 | 4,5 | 1 | 4,3 | 4 | 6,2 | 1 | 2,9 | 0,0 | 0,0 | 0,0 | |||||
|
Aurila cicatricosa (Reuss, 1850) |
1 | 0,8 | 2 | 1,6 | 1 | 0,5 | 1 | 1,0 | 1 | 1,5 | 4 | 11,4 | 5 | 7,2 | 0,0 | 1 | 0,8 | |||||||||||||
| Aurila cimbaeformis (Seguenza, 1883) | 2 | 1,6 | 4 | 3,2 | 1 | 0,5 | 3 | 1,6 | 3 | 1,6 | 8 | 4,2 | 2 | 1,9 | 6 | 3,4 | 1 | 4,3 | 2 | 5,7 | 4 | 5,8 | 5 | 5,8 | ||||||
|
Aurila convexa (Baird, 1850) |
13 | 10,2 | 12 | 9,7 | 12 | 5,7 | 12 | 7,7 | 20 | 10,9 | 12 | 6,3 | 16 | 8,3 | 9 | 5,0 | 4 | 6,2 | 5 | 14,3 | 4 | 5,8 | 20 | 23,3 | 13 | 10,2 | ||||
| Bairdia sp. A | 2 | 1,3 | 1 | 0,5 | 0,0 | 0,0 | 2 | 1,6 | ||||||||||||||||||||||
| Bairdia mediterranea Mueller, 1894 | 1 | 0,8 | 6 | 2,9 | 1 | 0,6 | 3 | 1,6 | 2 | 1,1 | 4 | 2,1 | 1 | 1,0 | 1 | 0,6 | 0,0 | 0,0 | 0,0 | |||||||||||
| Bosquetina carinella (Reuss, 1850) | 2 | 1,0 | 1 | 0,5 | 3 | 1,6 | 1 | 0,6 | 4 | 6,2 | 1 | 2,9 | 14 | 20,3 | 1 | 1,2 | 10 | 7,8 | ||||||||||||
| Bosquetina dentata (Mueller, 1894) | 1 | 0,8 | 4 | 1,9 | 4 | 2,1 | 4 | 2,1 | 2 | 1,1 | ||||||||||||||||||||
| Buntonia sublatissima (Neviani, 1906) | ||||||||||||||||||||||||||||||
| Bythocythere turgida Sars, 1866 | 2 | 1,0 | 4 | 2,6 | 3 | 2,9 | 0,0 | 0,0 | 0,0 | |||||||||||||||||||||
|
Callistocythere cf. C. pallida (Mueller, 1894) |
5 | 3,9 | 4 | 1,9 | 6 | 3,8 | 12 | 6,5 | 5 | 2,6 | 3 | 1,6 | 6 | 5,8 | 7 | 30,4 | 0,0 | 2 | 2,3 | 9 | 7,0 | |||||||||
| Carinocythereis carinata (Roemer, 1838) | 3 | 2,4 | 14 | 6,7 | 9 | 4,8 | 9 | 4,7 | 6 | 5,8 | 6 | 3,4 | 0,0 | 0,0 | 1 | 0,8 | ||||||||||||||
| Cistacythereis caelatura Uliczni, 1969 | 12 | 9,4 | 10 | 8,1 | 2 | 1,0 | 5 | 3,2 | 1 | 0,5 | 15 | 7,8 | 4 | 3,9 | 1 | 4,3 | 5 | 7,7 | 1 | 2,9 | 0,0 | 9 | 10,5 | 1 | 0,8 | |||||
| Costa edwardsii (Roemer, 1838) | 2 | 1,1 | ||||||||||||||||||||||||||||
|
Costa nudicosta Yassini, 1980 |
2 | 1,6 | 4 | 1,9 | 5 | 3,2 | 7 | 3,8 | 10 | 5,3 | 8 | 4,2 | 3 | 2,9 | 2 | 1,1 | 1 | 4,3 | 1 | 1,5 | 1 | 2,9 | 0,0 | 2 | 2,3 | 4 | 3,1 | |||
| Cyprideis ex groupe pannonica (Méhes, 1908) | 2 | 1,6 | 5 | 2,6 | 2 | 1,9 | 4 | 6,2 | 0,0 | 0,0 | 0,0 | |||||||||||||||||||
|
Cytherella cf. C. alvearium Bonaduce et al., 1975 |
1 | 0,8 | ||||||||||||||||||||||||||||
|
Cytherella cf.
C. circumpunctata Ciampo, 1976 |
6 | 3,8 | 6 | 5,8 | 1 | 0,6 | 1 | 2,9 | 1 | 1,4 | ||||||||||||||||||||
| Cytherella sp. | ||||||||||||||||||||||||||||||
| Cytherella vulgatella Aiello et al., 1996 | 3 | 2,4 | 5 | 4,0 | 8 | 3,8 | 6 | 3,1 | 12 | 6,7 | 2 | 8,7 | 2 | 5,7 | 2 | 2,9 | ||||||||||||||
| Cytherelloidea beckmanni Barbeito-Gonzalez, 1971 | 1 | 0,6 | 0,0 | 0,0 | 0,0 | |||||||||||||||||||||||||
|
Cytherelloidea cf. C. beckmanni Barbeito-Gonzalez, 1971 |
4 | 3,2 | 1 | 0,5 | 2 | 1,3 | 10 | 5,3 | 2 | 1,1 | 1 | 1,4 | 0,0 | 2 | 1,6 | |||||||||||||||
| Cytheretta subradiosa (Roemer, 1838) | 1 | 0,5 | 0,0 | 0,0 | 0,0 | |||||||||||||||||||||||||
| Cytheridea neapolitana Kolman, 1960 | 9 | 7,1 | 7 | 3,3 | 9 | 8,7 | 10 | 5,6 | 1 | 4,3 | 3 | 4,6 | 8 | 11,6 | 0,0 | 0,0 | ||||||||||||||
| Echinocythereis scabra (Muenster, 1830) | 2 | 1,3 | 1 | 0,5 | 2 | 1,0 | 0,0 | 0,0 | 0,0 | |||||||||||||||||||||
|
Celtia emaciata (Brady, 1867) |
0,0 | 0,0 | 0,0 | |||||||||||||||||||||||||||
|
Flexus triebeli (Ruggieri, 1962) |
3 | 2,4 | 10 | 4,8 | 6 | 3,3 | 10 | 5,3 | 8 | 4,2 | 4 | 3,9 | 3 | 1,7 | 1 | 2,9 | 5 | 7,2 | 7 | 8,1 | 7 | 5,5 | ||||||||
| Celtia quadridentata (Baird, 1850) | 2 | 1,0 | 4 | 2,6 | 1 | 0,5 | 4 | 3,9 | 3 | 4,6 | 0,0 | 0,0 | 0,0 | |||||||||||||||||
|
Celtia emaciata (Brady, 1867) |
1 | 0,6 | 2 | 1,9 | ||||||||||||||||||||||||||
| Leptocythere ramosa (Rome, 1942) | 2 | 1,6 | 2 | 1,0 | ||||||||||||||||||||||||||
|
Lixouria aquila Ruggeri, 1972 |
||||||||||||||||||||||||||||||
| Loxoconcha sp. 1 | 8 | 3,8 | 8 | 5,1 | 6 | 3,1 | 5 | 4,9 | 0,0 | 1 | 4,3 | 3 | 8,6 | 0,0 | 12 | 14,0 | 0,0 | |||||||||||||
| Loxoconcha sp. 2 | 5 | 4,0 | 1 | 2,9 | 1 | 1,4 | 0,0 | 1 | 0,8 | |||||||||||||||||||||
| Loxoconcha bairdi Mueller, 1912 | 4 | 3,1 | 2 | 1,6 | 6 | 2,9 | 5 | 3,2 | 4 | 2,2 | 1 | 4,3 | 0,0 | 0,0 | 0,0 | |||||||||||||||
| Microcytherura sp. | 7 | 3,3 | 0,0 | 4 | 2,2 | 6 | 3,2 | 6 | 3,1 | 4 | 2,2 | 1 | 4,3 | 1 | 1,4 | 1 | 1,2 | 8 | 6,3 | |||||||||||
| Miocyprideis italiana Moos, 1962 | 11 | 8,7 | 15 | 12,1 | 12 | 5,7 | 14 | 9,0 | 15 | 8,2 | 14 | 7,4 | 11 | 5,7 | 7 | 6,8 | 16 | 8,9 | 2 | 8,7 | 5 | 7,7 | 3 | 8,6 | 1 | 1,4 | 0,0 | 0,0 | ||
|
Monoceratina mediterranea Sissingh, 1972 |
1 | 0,8 | 1 | 0,5 | 3 | 1,9 | 2 | 1,1 | 4 | 2,2 | 0,0 | 0,0 | 1 | 0,8 | ||||||||||||||||
| Neocytherideis cylindrica (Brady, 1868) | 1 | 0,8 | 2 | 1,0 | 3 | 1,9 | 6 | 3,3 | 5 | 2,6 | 4 | 2,1 | 2 | 1,9 | 3 | 1,7 | 1 | 2,9 | 0,0 | 0,0 | 0,0 | |||||||||
| Palmoconcha agilis (Ruggieri, 1967) | ||||||||||||||||||||||||||||||
|
Palmoconcha dertobrevis (Ruggieri, 1967) |
1 | 0,8 | 8 | 6,5 | 3 | 2,9 | 0,0 | 0,0 | 0,0 | |||||||||||||||||||||
|
Paracypris polita Sars, 1866 |
||||||||||||||||||||||||||||||
| Paracytheridea depressa Mueller, 1894 | 1 | 0,5 | 2 | 1,0 | 0,0 | 0,0 | 5 | 3,9 | ||||||||||||||||||||||
|
Parakrithe robusta Bold, 1966 |
||||||||||||||||||||||||||||||
| Parakrithe sp. A | ||||||||||||||||||||||||||||||
| Pterygocythereis jonesii (Baird, 1850) | 4 | 1,9 | 1 | 0,6 | 6 | 3,3 | 6 | 3,2 | 2 | 1,9 | 6 | 3,4 | ||||||||||||||||||
| Pterygocythereis sp. 1 | ||||||||||||||||||||||||||||||
|
Quadracythere salebrosa (Uliczny, 1969) |
1 | 0,8 | 10 | 4,8 | 5 | 3,2 | 7 | 3,7 | 4 | 2,1 | 1 | 1,0 | 7 | 3,9 | 1 | 2,9 | 1 | 1,4 | 0,0 | 0,0 | ||||||||||
| Carinovalva carinata (Moyes, 1965) | ||||||||||||||||||||||||||||||
| Ruggieria tetraptera (Seguenza, 1880) | 5 | 3,9 | 2 | 1,6 | 9 | 4,9 | 6 | 3,2 | 4 | 3,9 | 12 | 6,7 | 5 | 7,7 | 4 | 5,8 | 2 | 2,3 | 4 | 3,1 | ||||||||||
| Urocythereis emanuelae Sciuto, 2014 | 2 | 1,6 | 7 | 5,6 | 12 | 5,7 | 6 | 3,8 | 12 | 6,5 | 24 | 12,7 | 20 | 10,4 | 4 | 3,9 | 15 | 8,4 | 1 | 4,3 | 10 | 15,4 | 1 | 2,9 | 10 | 14,5 | 23 | 26,7 | 20 | 15,6 |
| Xestoleberis communis Mueller, 1894 | 4 | 3,1 | 3 | 2,4 | 5 | 2,4 | 2 | 1,3 | 6 | 3,3 | 8 | 4,2 | 3 | 1,6 | 3 | 2,9 | 4 | 2,2 | 1 | 4,3 | 6 | 9,2 | 0,0 | 0,0 | 4 | 3,1 | ||||
| Xestoleberis margaritea (Brady, 1866) | 10 | 7,9 | 8 | 6,5 | 13 | 6,2 | 15 | 9,6 | 17 | 9,2 | 17 | 9,0 | 9 | 4,7 | 6 | 5,8 | 11 | 6,1 | 1 | 2,9 | 0,0 | 0,0 | 6 | 4,7 | ||||||
| Xestoleberis sp. A | 2 | 1,6 | 3 | 2,4 | 2 | 1,0 | 4 | 2,2 | 0,0 | 0,0 | 3 | 1,7 | 1 | 4,3 | 2 | 5,7 | 0,0 | 0,0 | 1 | 0,8 | ||||||||||
| nombre de spécimens par échantillon | 127 | 100 | 124 | 100 | 209 | 100 | 156 | 100 | 184 | 100 | 189 | 100 | 192 | 100 | 103 | 100 | 179 | 100 | 23 | 100 | 65 | 100 | 35 | 100 | 69 | 100 | 86 | 100 | 128 | 100 |
| nombre d'espèces par échantillon | 26 | 21 | 31 | 27 | 23 | 25 | 28 | 28 | 28 | 15 | 16 | 21 | 17 | 12 | 22 | |||||||||||||||
Toute la microfaune a été examinée et mesurée avec un microscope stéréoscopique. Les photos prises au MEB ont été réalisées au centre technologique de l'Université de Rabat (Maroc).
Certaines des espèces tunisiennes retrouvées ont été comparées avec les formes marocaines et espagnoles de la collection de référence de l'un d'entre nous (Driss Nachite) conservée au Département de Géologie de l'Université Abdelmalek Essaadi (Tétouan, Maroc).
L'interprétation paléoécologique ainsi que la distinction entre espèces indigènes et espèces déplacées ont été réalisées en tenant compte de l'information autoécologique des espèces individuelles, encore vivantes, et sur la base des données de la littérature et des synthèses (en particulier, Guernet & Lethiers, 1989 ; Montenegro et al., 1996 ; Lachenal, 1989 ; Smith & Horne, 2002). Par conséquent, les ostracodes furent regroupés en associations à signification paléoenvironmentale en relation avec leur distribution zonale benthique. Les associations suivantes ont été envisagées : associations de l'étage infralittoral, circalittoral et de transition. Un groupe supplémentaire, qui inclut les espèces sans signification spécifique et/ou mal représentées et les espèces remaniées, a été ajouté.
L'étude micropaléontologique de la coupe de l'Oued Lebna a mis en évidence une grande richesse et une importante diversification de la faune d'ostracodes. 54 espèces appartenant à 34 genres pour un total de 6000 valves et carapaces furent identifiées (Tableau 2). Les foraminifères sont moins abondants et répandus avec 13 espèces appartenant à 9 genres.
Les ostracodes (Tableau 2) sont régulièrement
distribués le long de la coupe à la fois qualitativement et quantitativement,
bien que l'abondance et la richesse des espèces sont corrélées généralement
positivement (Fig. 3 ![]() ). Les échantillons ont une richesse spécifique plutôt
faible variant entre 12 et 32, et une abondance comprise entre 23 et 333. Les échantillons
les plus riches en espèces et en spécimens sont Le14, Le13, Le0, Leb et Le1d ;
les plus pauvres sont les échantillons Le11, Le30, Le26, Le27, Le29, Lee et
Le16.
). Les échantillons ont une richesse spécifique plutôt
faible variant entre 12 et 32, et une abondance comprise entre 23 et 333. Les échantillons
les plus riches en espèces et en spécimens sont Le14, Le13, Le0, Leb et Le1d ;
les plus pauvres sont les échantillons Le11, Le30, Le26, Le27, Le29, Lee et
Le16.
Figure 3 :
Répartition des ostracodes (nombre d'espèces et
de spécimens). |
De
la comparaison des associations observées (Tableau 2), il est possible
d'identifier deux groupes d'échantillons qui caractérisent deux parties différentes
de la section. La partie inférieure de la coupe, soit le faciès marneux entre
l'échantillon Lea et l'échantillon Le1e, est caractérisée par
une ostracofaune peu diversifiée qui compte 38 espèces pour 1524 spécimens.
Les espèces les plus fréquentes et abondantes sont Aurila
convexa (Baird, 1850), Cytheridea
neapolitana
Kollmann, 1960 (Pl. 1 ![]() ,
fig. 6) et Costa edwardsii (Roemer, 1838) (Pl. 1
,
fig. 6) et Costa edwardsii (Roemer, 1838) (Pl. 1 ![]() ,
fig. 10),
puis en moindre abondance Cytherella sp., Loxoconcha sp.
et Cytherella cf. C. alvearium
Bonaduce
et al., 1975 (Pl. 1
,
fig. 10),
puis en moindre abondance Cytherella sp., Loxoconcha sp.
et Cytherella cf. C. alvearium
Bonaduce
et al., 1975 (Pl. 1 ![]() ,
fig. 2). Les formes les moins abondantes et
moins fréquentes sont Xestoleberis
spp., Buntonia sublatissima (Neviani,
1906) (Pl. 1
,
fig. 2). Les formes les moins abondantes et
moins fréquentes sont Xestoleberis
spp., Buntonia sublatissima (Neviani,
1906) (Pl. 1 ![]() ,
fig. 16), Leptocythere ramosa
(Rome, 1942) et Palmoconcha
agilis (Ruggieri, 1967) (Pl. 1
,
fig. 16), Leptocythere ramosa
(Rome, 1942) et Palmoconcha
agilis (Ruggieri, 1967) (Pl. 1 ![]() ,
fig. 19).
Uniquement dans cette partie de la coupe mais peu représentées, sont présentes
Parakrithe robusta Bold,
1966, Cytherella sp., Paracypris polita Sars,
1866, et
Lixouria aquila Ruggieri,
1972 (Pl. 1
,
fig. 19).
Uniquement dans cette partie de la coupe mais peu représentées, sont présentes
Parakrithe robusta Bold,
1966, Cytherella sp., Paracypris polita Sars,
1866, et
Lixouria aquila Ruggieri,
1972 (Pl. 1 ![]() ,
fig. 14).
,
fig. 14).
Dans le reste de la coupe, entre les échantillons Le-1 et le sommet, l'ostracofaune est plus diversifiée que celui de la partie basale et compte 52 espèces pour 4912 spécimens. Parmi ces espèces, la plus abondante et fréquente est Cytheretta subradiosa (Roemer, 1838) ; suivent moins abondantes et fréquentes Bairdia longevaginata Mueller, 1894, Citherelloidea beckmanni Barbeito-Gonzalez, 1971, et Neocytherideis cylindrica (Brady, 1868) ; Acanthocythereis hystrix (Reuss, 1850) et A. ascolii (Puri, 1963) sont faiblement représentées ; Aurila convexa, Cytheridea neapolitana et Costa edwardsi sont toujours abondantes et répandues ainsi que les espèces des genres Agilloecia et Xestoleberis (Tableau 2).
Il est important de signaler la
présence le long de la section de
Cyprideis ex groupe pannonica (Méhes, 1908) et Miocyprideis italiana Moos,
1962 (Pl. 1 ![]() ,
fig. 7). En particulier, M.
italiana est répandue mais en faible abondance le long de toute la coupe,
tandis que la présence de Cyprideis ex
groupe pannonica est limitée à la
partie supérieure. Vu la grande variabilité de ce taxon, en accord avec Gross et al.
(2008) et Ligios et Gliozzi
(2012), nous préférons parler de Cyprideis
ex groupe pannonica.
,
fig. 7). En particulier, M.
italiana est répandue mais en faible abondance le long de toute la coupe,
tandis que la présence de Cyprideis ex
groupe pannonica est limitée à la
partie supérieure. Vu la grande variabilité de ce taxon, en accord avec Gross et al.
(2008) et Ligios et Gliozzi
(2012), nous préférons parler de Cyprideis
ex groupe pannonica.
Les foraminifères de la coupe de
l'Oued Lebna sont plutôt pauvres en espèces et spécimens (Fig. 4 ![]() ). Parmi
les formes planctoniques, Globigerinoides
trilobus (Reuss, 1850) est largement répandue et
abondante tout le long de la série tandis
que Globigerinoides obliquus Bolli, 1957, Globigerinoides ruber (Orbigny, 1839) et
Globigerinoides elongatus (Orbigny, 1839) sont rares.
). Parmi
les formes planctoniques, Globigerinoides
trilobus (Reuss, 1850) est largement répandue et
abondante tout le long de la série tandis
que Globigerinoides obliquus Bolli, 1957, Globigerinoides ruber (Orbigny, 1839) et
Globigerinoides elongatus (Orbigny, 1839) sont rares.
Parmi les foraminifères benthiques, Ammonia beccarii (Linné, 1758) est répandue le long de toute la section ; Heterolepa sp., Pleurostomella sp., Uvigerina sp., Bolivina sp. et Elphidium crispum (Linné, 1758) sont plus rares et sont répandues le long de la partie supérieure de la coupe.
Parmi la
malacofaune (Fig. 4 ![]() ), le Scaphopode Dentalium sexangulare
Lamarck, 1818, se trouve exclusivement
dans la partie inférieure de la coupe tandis que les Lamellibranches Chlamys
varia (Linné, 1758), C. multistriata (Poli, 1795),
C. inequicostata (Young & Bird, 1840), Pecten
jacobaeus (Linné, 1758), Flabellipecten alessii (Philippi, 1836) et F. flabelliformis (Brocchi, 1814) sont présents dans la
partie supérieure.
), le Scaphopode Dentalium sexangulare
Lamarck, 1818, se trouve exclusivement
dans la partie inférieure de la coupe tandis que les Lamellibranches Chlamys
varia (Linné, 1758), C. multistriata (Poli, 1795),
C. inequicostata (Young & Bird, 1840), Pecten
jacobaeus (Linné, 1758), Flabellipecten alessii (Philippi, 1836) et F. flabelliformis (Brocchi, 1814) sont présents dans la
partie supérieure.
|
Figure 4 :
Répartition des foraminifères et des mollusques de
l'Oued Lebna. |
La faune de la partie inférieure de la coupe de
l'Oued Lebna (échantillons Lea - Le1e) se compose principalement d'espèces
typiques de la zone infralittorale jusqu'aux niveaux les plus superficiels de la
zone circalittorale ; à celles-ci s'ajoutent des espèces dont l'habitat peut
inclure toute la zone circalittorale (Fig. 5 ![]() ). Le premier groupe comprend des
espèces qui sont abondantes et fréquentes : Aurila convexa, Cytheridea
neapolitana, Costa edwardsii et Xestoleberis spp. Parmi elles, Aurila
convexa est très bien représentée ;
cette espèce est décrite comme une espèce épiphyte d'eaux peu
profondes (Athersuch et al.,
1989 ; Montenegro et al., 1996) ou opportuniste ubiquiste qui colonise tout le système littoral en Méditerrané
nord-occidentale (Nachite, 1984 ; Peypouquet & Nachite,
1983). Cytheridea neapolitana est également bien représentée ; elle
vit dans l'infralittoral et le circalittoral supérieur. Cette espèce se
trouve à Bou-Ismail Bay (Algérie) jusqu'à 100 m de profondeur (Yassini,
1980), sur le plateau tunisien de 24 à 175 m (Bonaduce
et al., 1988), dans l'archipel de la
Maddalena à 32 m de profondeur (Arbulla et
al., 2004), en Mer
Adriatique jusqu'à 166 m de profondeur (Bonaduce
et al., 1975), en Mer Ionienne jusqu'à
100 m de profondeur (Sciuto et al., 2015). Suit Costa edwardsii très répandue
en mer Méditerranée, où elle est connue comme une espèce d'eau peu
profondeinfralittoral à circalittoral supérieur (Athersuch et al.,
1989 ; Montenegro et al., 1996). En particulier, elle est rapportée à Bou-Ismail Bay
(Algérie) entre 25 et 100 m de profondeur (Yassini, 1979), dans
l'archipel de la Maddalena a moins de 32 m (Arbulla et al.,
2004), en Mer Adriatique, entre 24 et 125 m, dans le Golfe
de Naples entre 42 et 92 m (Bonaduce et
al., 1975), en Tunisie entre 1 et 110 m (Bonaduce et
al., 1988), dans le Golfe de Gascogne entre 50 et 110 m (Yassini,
1969). Enfin, les espèces du genre Xestoleberis
peuvent être considérées comme des taxons à large distribution écologique
parce qu'elles vivent à la fois en eau très peu profonde et en eau profonde.
). Le premier groupe comprend des
espèces qui sont abondantes et fréquentes : Aurila convexa, Cytheridea
neapolitana, Costa edwardsii et Xestoleberis spp. Parmi elles, Aurila
convexa est très bien représentée ;
cette espèce est décrite comme une espèce épiphyte d'eaux peu
profondes (Athersuch et al.,
1989 ; Montenegro et al., 1996) ou opportuniste ubiquiste qui colonise tout le système littoral en Méditerrané
nord-occidentale (Nachite, 1984 ; Peypouquet & Nachite,
1983). Cytheridea neapolitana est également bien représentée ; elle
vit dans l'infralittoral et le circalittoral supérieur. Cette espèce se
trouve à Bou-Ismail Bay (Algérie) jusqu'à 100 m de profondeur (Yassini,
1980), sur le plateau tunisien de 24 à 175 m (Bonaduce
et al., 1988), dans l'archipel de la
Maddalena à 32 m de profondeur (Arbulla et
al., 2004), en Mer
Adriatique jusqu'à 166 m de profondeur (Bonaduce
et al., 1975), en Mer Ionienne jusqu'à
100 m de profondeur (Sciuto et al., 2015). Suit Costa edwardsii très répandue
en mer Méditerranée, où elle est connue comme une espèce d'eau peu
profondeinfralittoral à circalittoral supérieur (Athersuch et al.,
1989 ; Montenegro et al., 1996). En particulier, elle est rapportée à Bou-Ismail Bay
(Algérie) entre 25 et 100 m de profondeur (Yassini, 1979), dans
l'archipel de la Maddalena a moins de 32 m (Arbulla et al.,
2004), en Mer Adriatique, entre 24 et 125 m, dans le Golfe
de Naples entre 42 et 92 m (Bonaduce et
al., 1975), en Tunisie entre 1 et 110 m (Bonaduce et
al., 1988), dans le Golfe de Gascogne entre 50 et 110 m (Yassini,
1969). Enfin, les espèces du genre Xestoleberis
peuvent être considérées comme des taxons à large distribution écologique
parce qu'elles vivent à la fois en eau très peu profonde et en eau profonde.
Figure 5 :
Répartition des groupes paléoenvironnementaux de
la coupe de l'Oued Lebna. |
Le deuxième groupe comprend des espèces certainement moins abondantes et fréquentes bien qu'importantes du point de vue environnemental. Ce sont Acanthocythereis spp., Argilloecia spp., Cytherella cf. C. circumpunctata, Cytherella sp., Parakrithe robusta, Cytherella cf. C. alvearium et Lixouria aquila Ruggeri, 1972. Cette partie de la coupe est caractérisée par l'absence d'espèces exclusives de l'étage infralittoral. La présence de l'espèce d'eau saumâtre Miocyprideis italiana est particulièrement significative. L'association d'ostracodes découverte dans cette partie de la coupe indiquerait un paléoenvironnement de fonds meubles assez profonds de l'étage circalittoral (probablement à environ 100 mètres de profondeur) à sédimentation pélitique. Cela est aussi en accord avec la présence de genres tels Argilloecia et Parakrithe qui préfèrent des environnements à sédimentation fine (Montenegro et al., 1996).
L'association autochtone est affectée par des apports continentaux (M. italiana) dus à la permanence des milieux lagunaires et/ou estuariens relativement bien développés dans les environnements côtiers avoisinants.
Dans la partie supérieure de la coupe (échantillons
Le 1 jusqu'au sommet), nous assistons à l'apparition et à une augmentation
progressive des espèces typiques de l'étage infralittoral (Tableau 2) qui
sont Cytheretta subradiosa Cytherelloidea
beckmanni, Bairdia longevaginata, Urocythereis emanuelae Sciuto,
2014
(Pl. 1 ![]() , fig. 17), et
Neocytherireis cylindrica, tandis que les espèces des étages circalittoral
et infralittoral-circalittoral supérieur, qui étaient dominantes, diminuent
progressivement en fréquence et en abondance (Fig. 6
, fig. 17), et
Neocytherireis cylindrica, tandis que les espèces des étages circalittoral
et infralittoral-circalittoral supérieur, qui étaient dominantes, diminuent
progressivement en fréquence et en abondance (Fig. 6 ![]() ).
).
Figure 6 :
Distribution des espèces de l'étage
infralittoral (A) et de l'étage infralittoral-circalittoral supérieur (B) de
la coupe de l'Oued Lebna. |
La présence de Cytherelloidea beckmanni et Cytheretta subradiosa dans ces niveaux revêt une importance environnementale considérable, car ces espèces sont caractéristiques des milieux très superficiels (Bonaduce et al., 1985 ; Aranki, 1987, entre autres). Une autre espèce significative est Urocythereis emanuelae trouvée dans les sédiments marins limoneux-sableux blanchâtres d'eau peu profonde du Pléistocène inférieur de la Sicile sud orientale (Sciuto, 2014 ; Sciuto et al., 2015). Cette association d'ostracodes indiquerait une diminution progressive de la profondeur du bassin sédimentaire situé dans des milieux à sédimentation sableuse de l'étage infralittoral dans lesquels se poursuit l'apport d'espèces d'eau douce.
Du point de vue stratigraphique par rapport aux foraminifères planctoniques retrouvés, conformément à Iaccarino & Premoli Silva (2007), Globigerinoides obliquus est présente de MMi2 (Burdigalien) jusqu'à MPl5a (Plaisancien), tandis que Globigerinoides elongatus est présente de MPl3 jusqu'à l'actuel ; la présence simultanée de ces deux espèces sélectionnées indique un intervalle compris entre la Biozone MPL3 et la Sous-Zone MPl5a, ou bien à partir du milieu du Zancléen jusqu'à la base du Gélasien (Pliocène inferieur - Pléistocène inférieur).
Du point de vue paléoclimatique,
il est important de noter la présence dans les niveaux élevés de la section
de l'espèce Bythocythere turgida Sars, 1866
(Pl. 1 ![]() ,
fig. 5). Actuellement cette espèce est citée de la côte atlantique de la Norvège à la Mer Arctique
(Sars, 1866 ; Elofson
1941 ; Athersuch et al.,
1983
; Faranda & Gliozzi, 2011). En Mer Méditerranée,
il n'y a aucune mention de spécimens vivants, seulement de valves (Breman,
1976, entre autres) qui peuvent être liées au "Last Pleniglacial Maximum
migration" (Faranda
& Gliozzi, 2011). Dans la région méditerranéenne,
l'espèce fossile n'est signalée que dans les sédiments des périodes
froides du Pléistocène (Ruggieri, 1976 ; Vertino et
al., 2010 ; Faranda & Gliozzi,
2011 ; Sciuto 2015)
jusqu'au dernier stade glaciaire ; selon Faranda & Gliozzi
(2011), cette espèce peut être considérée comme un véritable "Northern
Guest". La présence de B. turgida dans cette région, en démontrant un refroidissement de
la Méditerranée, nous permet de rapporter en toute probabilité, la partie supérieure
de la section de l'Oued Lebna au Pléistocène inférieur (Gélasien).
,
fig. 5). Actuellement cette espèce est citée de la côte atlantique de la Norvège à la Mer Arctique
(Sars, 1866 ; Elofson
1941 ; Athersuch et al.,
1983
; Faranda & Gliozzi, 2011). En Mer Méditerranée,
il n'y a aucune mention de spécimens vivants, seulement de valves (Breman,
1976, entre autres) qui peuvent être liées au "Last Pleniglacial Maximum
migration" (Faranda
& Gliozzi, 2011). Dans la région méditerranéenne,
l'espèce fossile n'est signalée que dans les sédiments des périodes
froides du Pléistocène (Ruggieri, 1976 ; Vertino et
al., 2010 ; Faranda & Gliozzi,
2011 ; Sciuto 2015)
jusqu'au dernier stade glaciaire ; selon Faranda & Gliozzi
(2011), cette espèce peut être considérée comme un véritable "Northern
Guest". La présence de B. turgida dans cette région, en démontrant un refroidissement de
la Méditerranée, nous permet de rapporter en toute probabilité, la partie supérieure
de la section de l'Oued Lebna au Pléistocène inférieur (Gélasien).
Aguirre E. & Pasini G. (1985).- The Pliocene-Pleistocene boundary.- Episodes, vol. 8, p. 116-120.
Aranki J.T. (1987).- Marine Lower Pliocene Ostracoda of Southern Spain with notes on the recent fauna.- Bulletin of the Geological Institutions of the University of Uppsala, (N.S.), vol. 13, p. 1-144.
Arbulla D., Pugliese N. & Russo A. (2004).- Ostracods from the National Park of La Maddalena Archipelago (Sardinia, Italy).- Bollettino della Società Paleontologica Italiana, vol. 43, nº 1-2, p. 91-99.
Athersuch J., Horne D.J. & Whittaker J.E. (1983).- Some species of the ostracod genus Bythocythere Sars from British waters.- Journal of Micropalaeontology, vol. 2, p. 71-81.
Athersuch J., Horne D.J. & Whittaker J.E. (1989).- Marine and brackish water ostracods.- Synopses of the British Fauna, London, (N. S.), vol. 43, 343 p.
Ayress M., Neil H., Passlow V. & Swanson K. (1997).- Benthonic ostracods and deep watermasses: A qualitative comparison of Southwest Pacific, Southern and Atlantic Oceans.- Palæogeogeography, Palæoclimatology, Palæoecology, vol. 131, p. 287-302.
Bassett M.G. (1985).- Towards a 'common language' in stratigraphy.- Episodes, vol. 8, p. 87-92.
Ben Salem H. (1992).- Contribution à la connaissance de la géologie du Cap Bon : Stratigraphie, tectonique et sédimentologie.- Thèse de 3ème Cycle, Faculté des Sciences de Tunis, 203 p.
Bonaduce G., Ciampo G. & Masoli M. (1975).- Distribution of Ostracoda in the Adriatic sea.- Publicazioni della Stazione Zoologica di Napoli, vol. 40 Suppl., 304 p.
Bonaduce G., Masoli M. & Pugliese N. (1988).- Remarks on the benthic Ostracoda on the Tunisian shelf. In : Hanai T., Ikeya N. & Ishizaki K. (éds.), Evolutionary biology of Ostracoda its fundamentals and applications. Proceedings of the Ninth International Symposium on Ostracoda, Japan (29 July-2 August, 1985).- Developments in Palaeontology and Stratigraphy, vol. 11, p. 449-466.
Breman E. (1975).- Ostracodes in a bottom core from the deep southeastern basin of the Adriatic Sea.- Koninklijke Nederlandse Akademie van Wetenschappen, Proceedings, (Ser. B), vol. 78, p. 198-218.
Burollet P.F. (1951).- Étude géologique des bassins mio-pliocènes du Nord-Est de la Tunisie : Région entre Mateur, Ferryville et Porto-Farina.- Annales des Mines et de la Géologie, Tunis, nº 8, 94 p.
Cita M.B. (2008).- Summary of Italian marine stages of the Quaternary.- Episodes, vol. 29, p. 107-114.
Colleuil B. (1976).- Étude stratigraphique et néotectonique des formations néogènes et quaternaires de la région de Nabeul-Hammamet (Cap-Bon, Tunisie).- Mémoire de D.E.S., Nice, 94 p.
Dammak F. (1992).- Biostratigraphie, sédimentologie et paléoenvironnement du Pliocène de la région de Nabeul-Hammamet (Cap-Bon, Tunisie).- Thèse de 3ème Cycle, Faculté des Sciences de Tunis, 151 p.
Dammak F. & Zaghbib-Turki D. (2002).- Identification des zones biostratigraphiques méditerranéennes dans le Pliocène du Cap-Bon (Tunisie).- Geobios, vol. 35, p. 253-264.
Elofson O. (1941).- Zur Kenntnis der marinen Ostracoden Schwedens mit besonderer Berücksichtigung des Skageraks.- Zoologiska Bidrag från Uppsala, vol. 19, p. 215-534.
Faranda C. & Gliozzi E. (2011).- A revision of the "northern guest" Ostracoda (Crustacea) occurrence in the Quaternary of the Mediterranean area.- Il Quaternario, vol. 24, p. 75-92.
Feki M. (1970).- Paléoécologie du Pliocène marin au Nord de la Tunisie.- Thèse de Doctorat d'État es Sciences naturelles, Faculté des Sciences de Paris, 363 p.
Fournié D. (1978).- Nomenclature lithostratigraphique des séries du Crétacé inférieur au Tertiaire de la Tunisie.- Bulletin du Centre de Recherches Exploration Production elf-Aquitaine, vol. 2, p. 97-14.
Frenzel P. & Boomer I. (2005).- The use of ostracods from marginal marine, brackish waters as bioindicators of modern and Quaternary environmental change.- Palæogeography, Palæoclimatology, Palæoecology, vol. 225, nº 1-4, p. 68-92.
Gibbard P. & Cohen K.M. (2008).- Global chronostratigraphical correlation table for the last 2.7 million years.- Episodes, vol. 31, nº 2, p. 243-247.
Gibbard P.L. & Head M.J. (2009).- IUGS ratification of the Quaternary System/Period and the Pleistocene Series/Epoch with a base at 2.58 Ma.- Quaternaire, vol. 20, p. 411-412.
Gibbard P.L. & Head M.J. (2010).- The newly-ratified definition of the Quaternary System/Period and redefinition of the Pleistocene Series/Epoch, and comparison of proposals advanced prior to formal ratification.- Episodes, vol. 33, p. 152-158.
Gibbard P.L., Head M.J., Walker M.J.C. & The Subcommission on Quaternary Stratigraphy (2010).- Formal ratification of the Quaternary System/Period and the Pleistocene Series/Epoch with a base at 2.58 Ma.- Journal of Quaternary Science, vol. 25, p. 96-102.
Gliozzi E. & Grossi F. (2008).- Multivariate analysis as a tool to infer the autoecology of extinct ostracods: An example from two Italian late Messinian lago-mare assemblages.- Palæogeography, Palæoclimatology, Palæoecology, vol. 264, p. 288-295.
Gross M., Minati H., Danielopol D.L. & Piller W.E. (2008).- Environmental changes and diversification of Cyprideis in the Late Miocene of the Styrian Basin (Lake Pannon, Austria).- Senckembergiana Lethaea, vol. 88, nº 1 , p. 161-181.
Guernet C. & Lethiers F. (1989).- Ostracodes et recherche des milieux anciens : Possibilités et limites.- Bulletin de la Société géologique de France, Paris, vol. 8, nº 5, p. 577-588.
Hoek W.Z. (2008).- The last Glacial - Interglacial transition.- Episodes, vol. 31, p. 226-229.
Hooybergs H.J.F. (1977).- Stratigraphie Van de Olig-Mio-en Pliocene afzettigen in het N.E. Van Tunisie, meteen Bijzondere Studie Van de planktonische Foraminiferen.- Thesis Katholieke Universiteit Leuven, vol. 1: Stratigraphie, vol. 2: Systematik, 409 p.
Hooyberghs H.J.F. (1991).- Contribution à l'étude des Foraminifères planctoniques du Pliocène du NE de la Tunisie.- Notes du Service géologique de Tunisie, vol. 58, p. 43-99.
Hooyberghs H.J.F. (1995).- Synthèse sur la stratigraphie de l'Oligocène, Miocène et Pliocène de Tunisie.- Notes du Service géologique de Tunisie, vol. 61, p. 63-72.
Iaccarino S. (1985).- Miocene and Pliocene planktic foraminifera. In : Bolli H.M., Saunders J.B. & Perch-Nielsen K. (éds.), Plankton Stratigraphy.- Cambridge University Press, N.Y., p. 283-314
Iaccarino S. & Premoli Silva I. (2007).- Practical manual of neogene planktonic foraminiferal.- International Scool in Planktonic Foraminifera, VI Course, Neogene, Perugia (February 19-23, 2007), 141 p.
Lachenal A.-M. (1989).- Écologie des ostracodes du domaine méditerranéen : Application au Golfe de Gabès (Tunisie orientale).- Documents des Laboratoires de Géologie de Lyon, vol. 108, 239 p.
Ligios S. & Gliozzi E. (2012).- The genus Cyprideis Jones, 1857 (Crustacea, Ostracoda) in the Neogene of Italy: A geometric morphometric approach.- Revue de Micropaléontologie, vol. 55, p. 171-207.
Lourens L.J., Hilgen F.J., Laskar J., Shackleton N.J. & Wilson D. (2004).- The Neogene Period. In : Gradstein F.M., Ogg J.G. & Smith A.G. (éds.), A geologic time scale 2004.- Cambridge University Press, N.Y., p. 409-440.
Majoran S. & Dingle R.V. (2001).- Palaeoceanographical changes recorded by Cenozoic deep-sea ostracod assemblages from the South Atlantic and the Southern Ocean (ODP Sites 1087 and 1088).- Lethaia, Oslo, vol. 34, p. 63-84.
Mischke S. & Holmes J. (2008).- Applications of lacustrine and marginal-marine Ostracoda to palaeoenvironmental reconstruction.- Palæogeography, Palæoclimatology, Palæoecology, vol. 264, p. 211-212.
Montenegro M.E., Pugliese N. & Bonaduce G. (1996).- Shelf ostracods distribution in the Italian seas. In : Crasquin-Soleau S., Braccini E. & Lethiers F. (éds.), What about Ostracoda.- Bulletin du Centre Recherche elf-Aquitaine Exploration Production, vol. 20, p. 91-101.
Nachite D. (1984, inédit).- Les Ostracodes de plate-forme et du domaine profond de la Méditerranée occidentale durant le Quaternaire terminal.- Thèse de Doctorat 3e cycle, Université de Bordeaux 1, 131 p.
Office national des Mines (2006).- Carte géologique de la Tunisie, échelle 1:50.000.- Office national des Mines, Tunis.
Peypouquet J.P. & Nachite D. (1983).- Les ostracodes en Méditerranée nord-occidentale. In : Bizon J.-J. & Burollet P.-F. (éds.), Écologie des microorganismes en Méditerranée occidentale, "ECOMED".- Association française des Techniciens du Pétrole, Paris, p. 151-169.
Rodriguez-Lazaro J. & Ruiz-Muñoz F. (2012).- A general introduction to Ostracods: Morphology, distribution, fossil record and applications. In : Horne D.J., Rodriguez-Lazaro J., Holmes J.A. & Viehberg F. (éds.), Ostracoda as proxies for Quaternary climate change.- Developments in Quaternary Science, vol. 17, p. 1-14.
Ruggieri G. (1976).- Ostracofauna tortoniana di Camporosso (Perticara, Appennino romagnolo).- Bollettino della Società Paleontologica Italiana, Modena, vol. 15, nº 2, p. 175-187.
Sars G.O. (1866).- Oversight af Norges marine Ostracoder.- Forhandlinger i Videnskabs Selskabet i Christiania, vol. 7, p. 1-130.
Sciuto F. (2003).- Dati preliminari sulla ostracofauna pliocenica di Capo Milazzo (Sicilia NE).- Bollettino della Società Paleontologica Italiana, vol. 42, no 2, p. 179-184.
Sciuto F. (2005).- Ostracodi batiali pleistocenici di Capo Milazzo (Sicilia NE) ed implicazioni paleoambientali.- Rendiconti della Società Paleontolologica Italiana, vol. 2, p. 219-227.
Sciuto F. (2014).- Ostracods of the Upper Pliocene-Pleistocene Punta Mazza succession (NE Sicily) with special focus on the family Trachyleberididae Sylvester-Bradley, 1948 and description of a new species.- Carnets Geol., vol. 14, nº 1, p. 1-13.
Sciuto F., Rosso A., Sanflippo R. & Maniscalco R. (2015).- New faunistic data on the Pleistocene environmental evolution of the south-western edge of the Hyblean Plateau (SE Sicily).- Carnets Geol., vol. 15, nº 5, p. 41-57.
Smith A.J. & Horne D.J. (2002).- Ecology of marine, marginal marine and non marine Ostracodes. In : Holmes J.A. & Chivas A.R. (éds.), The Ostracoda: Application in Quaternary research.- Geophysical Monograph, American Geophysical Union, vol. 131, p. 37-64.
Temani R. ( 2007).- Les dépôts du Messinien, du Pliocène et du Quaternaire au Cap Bon et au Golfe de Hammamet.- Mastère de Géologie, Faculté des Sciences de Tunis, 120 p.
Vertino A., Savini A., Rosso A., Di Geronimo I., Mastrototaro F., Sanfilippo R. & Etiope G. (2010).- Benthic habitat characterization and distribution from two representative sites of the deep-water SML Coral Province (Mediterranean).- Deep Sea Research Part II: Topical Studies in Oceanography, vol. 57, p. 380-396.
Violanti
D. (2012).- 6. Pliocene Mediterranean foraminiferal biostratigraphy: A synthesis
and application to the paleoenvironmental evolution of Northwestern Italy. In
: Elitok Ö. (éd.),
Stratigraphic analysis of layered deposits.- In Tech, Rijeka, p. 123-160. URL : http://cdn.intechopen.com/pdfs/36321/InTechPliocene_mediterranean_foraminiferal_biostratigraphy_
a_synthesis_and_application_to_the_paleoenvironmental_evolution_of_northwestern_italy.pdf
Yassini I. (1969).- Écologie des associations d'Ostracodes du bassin d'Arcachon et du littoral atlantique. Application à l'interprétation de quelques populations du Tertiaire.-Bulletin de l'Institut géologique du Bassin d'Aquitaine, Bordeaux, vol. 7, 288 p.
Yassini I. (1979).- The littoral system Ostracodes from the Bay of Bou-Ismail, Algiers, Algeria.- Revista Española de Micropaleontología, vol. 11, p. 353-416.
Yassini I. (1980).- Répartition des ostracodes dans une série marine régressive d'âge Pliocène dans la région d'Alger, Algérie.- Revue de Micropaléontologie, Paris, vol. 22, p. 89-124.
Zaîbi C., Kamoun F., Carbonel P. & Montacer M. (2011).- Distribution des ostracodes dans les sédiments de subsurface de la Sebkha El-Guettiate (Skhira, golfe de Gabès). Intérêt pour la reconstitution des paléo-environnements de l'Holocène.- Carnets Geol., vol. 11, nº A03 (CG2011_A03), p. 63-81.
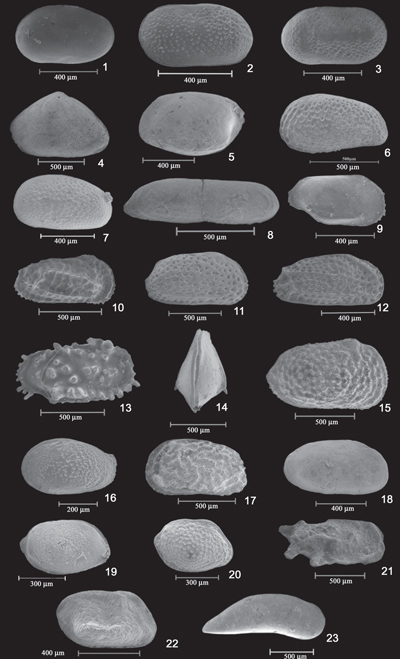
Cliquer sur la vignette pour agrandir l'image.
Planche 1 : Ostracodes
Plate 1: Ostracods
1. Cytherella sp. VG/LV ; 2. Cytherella cf. C. alvearium Bonaduce et al., 1975. VG/LV ; 3. Cytherella cf. C. circumpunctata Ciampo, 1976. VD/RV ; 4. Eucypris (?) sp. VG/LV ; 5. Bythocythere turgida Sars, 1866. VG/LV ; 6. Cytheridea neapolitana Kollmann, 1960. VG/LV ; 7. Miocyprideis italiana Moos, 1962. VG/LV ; 8. Neocytherideis cylindrica (Brady, 1869). VD/RV ; 9. Bosquetina dentata (Muller, 1894). VD/RV ; 10. Costa edwardsii (Roemer, 1838). VD/RV ; 11. Falunia emaciata Brady, 1868. VD/RV ; 12. Falunia quadridentata (Baird, 1850). VD/RV ; 13. Pterygocythereis jonesii (Baird, 1850). VD/RV ; 14. Lixouria aquila Ruggieri, 1972. VD/RV ; 15. Echinocythereis scabra (Muenster, 1830). VD/RV ; 16. Buntonia sublatissima (Neviani) 1976. VG/LV ; 17. Urocythereis emanuelae Sciuto, 2014. VG/LV ; 18. Cytheretta subradiosa (Roemer, 1838). VD/RV ; 19. Palmoconcha agilis (Ruggieri, 1967). VD/RV ; 20. Palmoconcha dertobrevis (Ruggieri, 1967). VD/RV ; 21. Paracytheridea depressa G.W. Müller, 1894. VD/RV ; 22. Monoceratina mediterranea Sissingh, 1972. VD/RV ; 23. Paracypris polita Sars, 1866. VD. VD/RV : valve droite (right valve); VG/LV : valve gauche (left valve).